ในทางเคมีอินทรีย์นั้น
สารประกอบอินทรีย์เฮไลด์
(organic
halide)
คือสารประกอบที่มีธาตุในหมู่ฮาโลเจนสร้างพันธะเข้ากับอะตอมคาร์บอน
ถ้าอะตอมคาร์บอนนั้นไม่ใช่ส่วนหนึ่งของวงแหวนอะโรมาติก
สารประกอบนั้นก็จัดว่าในกลุ่มอัลคิลเฮไลด์
(alkyl
halide) แต่ถ้าอะตอมคาร์บอนนั้นเป็นส่วนหนึ่งของวงแหวนอะโรมาติก
สารประกอบนั้นก็จัดว่าอยู่ในกลุ่มเอริลเฮไลด์
(aryl
halide)
ในส่วนของอัลคิลเฮไลด์นั้นยังมีการจำแนกออกเป็นชนิดปฐมภูมิ
(primary
- 1º) ทุติยภูมิ
(secondary
- 2º) และตติยภูมิ
(tertiary
- 3º) โดยดูจากอะตอม
C
ที่มีอะตอมเฮไลด์เกาะอยู่
ว่าอะตอม C
นั้นมีพันธะเชื่อมต่อกับอะตอม
C
ตัวอื่นอีกกี่ตัว
ถ้ามีการเชื่อมต่อกับอะตอม
C
ตัวอื่นเพียงตัวเดียว
(ที่เหลืออีก
๒ เป็นอะตอม H)
ก็จัดว่าเป็นชนิดปฐมภูมิ
ถ้ามีการเชื่อมต่อกับอะตอม
C
อื่นอีก
๒ ตัว (อีก
๑ เป็นอะตอม H)
ก็จัดว่าเป็นชนิดทุติยภูมิ
และถ้าอะตอม C
นั้นเชื่อมต่อเข้ากับอะตอม
C
อื่นอีก
๓ ตัว ก็จัดว่าเป็นชนิดตติยภูมิ
(รูปที่
๑)
รูปที่
๑ ตัวอย่างการจำแนกประเภทของสารประกอบเฮไลด์ออกเป็นชนิด
ปฐมภูมิ ทุติยภูมิ และตติยภูมิ
ทุกตัวเป็นสารประกอบอัลคิลเฮไดล์
ยกเว้นตัวสุดท้ายที่อะตอม
Cl
เกาะกับอะตอม
C
ที่เป็นส่วนหนึ่งของวงแหวนเบนซิน
สารประกอบนี้จึงเป็นเอริลเฮไลด์
สารประกอบอินทรีย์เฮไลด์นั้นแทบไม่มีปรากฏในธรรมชาติ
(ยกเว้นในสาหร่ายทะลบางชนิด)
ดังนั้นถ้าตรวจพบว่ามีสารประกอบอินทรีย์เฮไลด์ในธรรมชาติ
ก็เชื่อได้ว่าสารนั้นป็นสารที่มนุษย์สังเคราะห์ขึ้นและมีการรั่วไหลหรือปล่อยออกสู่ธรรมชาติ
ในตำราเคมีอินทรีย์นั้น
อะตอมฮาโลเจนที่ปรากฏอยู่เป็นประจำของสารประกอบอินทรีย์เฮไลด์คือ
คลอรีน (Cl)
โบรมีน
(Br)
และ
ไอโอดีน (I)
ส่วนฟลูออรีน
(F)
นั้นแม้ว่าจะเป็นธาตุฮาโลเจนเช่นกัน
แต่ก็แทบไม่ได้รับการกล่าวถึงในตำราอินทรีย์เคมี
เหตุผลหนึ่งก็เพราะ F
มีความว่องไวในการทำปฏิกิริยาสูงมากจนยากต่อการควบคุม
(ทำปฏิกิริยาการออกซิไดซ์อย่างแรงกับสารอินทรีย์ต่าง
ๆ)
ทำให้ไม่ปลอดภัยในการเตรียมสารประกอบฟลูออรีนในระดับห้องปฏิบัติการทั่วไป
(ส่งผลให้ยากต่อการศึกษาวิจัย)
เรื่องเกี่ยวกับฟลูออรีนนี้เคยเล่าไว้บ้างแล้วใน
Memoir
ปีที่
๒ ฉบับที่ ๙๒ วันจันทร์ที่
๒๑ ธันวาคม ๒๕๕๒ เรื่อง
"ฟลูออรีนหายไปไหน"
ประโยชน์หนึ่งของสารประกอบอินทรีย์เฮไลด์คือใช้เป็นสารมัธยันต์
(intermediate)
ในการเตรียมสารอื่น
ด้วยการแทนที่อะตอม H
ด้วยอะตอมฮาโลเจนก่อน
จากนั้นจึงค่อยแทนที่อะตอมฮาโลเจนด้วยหมู่ฟังก์ชันหมู่อื่นอีกที
วิธีการนี้ใช้ได้ดีกับกรณีของสารประกอบอัลคิลเฮไลด์
เพราะปฏิกิริยาการแทนที่อะตอม
H
ของอะตอม
C
ที่ไม่ใช่ส่วนหนึ่งของวงแหวนเบนซีนด้วยอะตอมฮาโลเจนนั้นเกิดได้ง่าย
(การแทนที่อะตอม
H
ของอะตอม
C
ที่เป็นส่วนหนึ่งของวงแหวนเบนซีนเกิดได้ยากกว่ามาก
อาจต้องใช้ตัวเร่งปฏิกิริยาช่วย)
นอกจากนี้ยังไม่ต้องกังวลว่าจะเกิดการตัดสายโซ่โมเลกุลสารตั้งต้นให้กลายเป็นโมเลกุลที่เล็กลง
(เช่นการออกซิไดซ์อัลเคนด้วยออกซิเจน
O2
มักจะมีการตัดสายโซ่โมเลกุลอัลเคนร่วมอยู่ด้วยเสมอเพราะต้องใช้ภาวะการทำปฏิกิริยาที่รุนแรง
ในขณะที่การทำปฏิกิริกับ
Cl2
หรือ
Br2
จะไม่ประสบปัญหาดังกล่าว)
นอกจากนี้การที่อะตอมฮาโลเจนนั้นมีขนาดใหญ่
ทำให้พันธะ C-X
(เมื่อ
X
คือ
Cl,
Br หรือ
I)
มีความยาวพันธะมาก
พันธะจึงไม่แข็งแรง
หลุดออกจากกันได้ง่าย
และการที่อะตอมฮาโลเจนมีค่า
electronegativity
สูงกว่าอะตอม
C
จึงทำให้อะตอม
C
ที่มีอะตอมฮาโลเจนเกาะอยู่นั้นมีความเป็นขั้วบวก
ไอออนที่เป็นลบหรือโมเลกุลที่มีอิเล็กตรอนคู่โดดเดี่ยวจึงสามารถทำปฏิกิริยากับอะตอม
C
ตัวดังกล่าวได้ง่ายขึ้น
ในช่วงแรกนี้จะขอกล่าวถึงการทำปฏิกิริยาของสารประกอบอัลคิลเฮไลด์ก่อน
(เมื่อ
X
= Cl, Br หรือ
I)
การเกิดปฏิกิริยาของสารประกอบอัลคิลเฮไลด์นั้นเป็นปฏิกิริยาในรูปแบบ
nucleophilic
substitution (SN) คือการแทนที่อะตอมฮาโลเจนด้วย
nucleophile
(ย่อว่า
Nu
คือสารที่ชอบนิวเคลียส
(ประจุบวก,
ขั้วบวก)
ซึ่งได้แก่ไอออนลบหรืออะตอมที่มีอิเล็กตรอนคู่โดดเดี่ยว
โดยในการเกิดปฏิกิริยานั้นอาจเริ่มจาก
(ก)
การที่โมเลกุลอัลคิลเฮไลด์แตกพันธะ
C-X
ออกเป็น
carbocation
กับไอออนลบของฮาโลเจนก่อนที่
Nu
จะเข้ามาทำปฏิกิริยากับ
carbocation
หรือ
(ข)
การที่
Nu
นั้นเข้ามาทำปฏิกิริยาที่อะตอม
C
ที่มีฮาโลเจนเกาะอยู่โดยตรง
โดยที่ไม่จำเป็นต้องมีการแตกพันธะ
C-X
ก่อน
รูปที่
๒ การแตกตัวของสารประกอบอัลคิลเฮไลด์ออกเป็น
carbocation
และไอออนลบ
การเกิดปฏิกิริยาในรูปแบบ
(ก)
(รูปที่
๒)
นั้นขึ้นอยู่กับว่า
carbocation
และไอออนลบของฮาโลเจนที่เกิดขึ้นนั้นมีเสถียรภาพมากน้อยเพียงใด
ในส่วนของไอออนลบของฮาโลเจนนั้นเป็นที่ทราบกันทั่วไปว่ามีเสถียรภาพสูง
(เห็นได้จากกรดพวก
HCl
HBr และ
HI
ที่ต่างเป็นกรดแก่
เพราะไอออนลบ Cl-
Br-
และ
I-
นั้นมีความหนาแน่นประจุต่ำ
สามารถอยู่ได้ด้วยตัวมันเองได้โดยไม่ดึง
H+
กลับเข้าหาตัว)
ดังนั้นปฏิกิริยาในรูปแบบนี้จะเกิดได้ง่ายหรือยากนั้นจึงไปขึ้นอยู่กับเสถียรภาพของ
carbocation
ที่เกิดขึ้น
ถ้า carbocation
ที่เกิดขึ้นนั้นมีเสถียรภาพสูง
มันก็จะสามารถคงอยู่และทำปฏิกิริยากับ
Nu
ได้
แต่ถ้า carbocation
ที่เกิดขึ้นนั้นมีเสถียรภาพต่ำ
มันก็จะดึงเอาไอออนลบของฮาโลเจนกลับคืนตัวมันเอง
เนื่องจากเสถียรภาพของ
carbocation
นั้นเรียงตามลำดับ
3º > 2º >
1º สารประกอบอัลคิลเฮไลด์ชนิด
3º
จึงเกิดปฏิกิริยาในรูปแบบนี้ได้ง่ายกว่าชนิด
2º และชนิด
2º
ก็เกิดได้ง่ายกว่าชนิด
1º
การเกิดปฏิกิริยาในรูปแบบนี้พบว่าอัตราการเกิดปฏิกิริยาขึ้นอยู่กับความเข้มข้นของสารอินทรีย์เฮไลด์ที่เป็นสารตั้งต้น
ไม่ขึ้นอยู่กับความเข้มข้นของ
Nu
ที่เข้ามาทำปฏิกิริยา
อัตราการเกิดปฏิกิริยาจึงเป็นปฏิกิริยาอันดับหนึ่ง
(1st
order reaction) หรือเขียนย่อว่า
SN1
รูปที่
๓ ข้างล่างเป็นการเปรียบเทียบอัตราเร็วในการทำปฏิกิริยา
nucleophilic
substitution ของเมทิลโบรไมด์เทียบกับสารประกอบ
1º
2º และ
3º
โบรไมด์
รูปที่
๓ เปรียบเทียบอัตราเร็วในการทำปฏิกิริยา
nucleophilic
substitution ของสารประกอบอัลคิลโบรไมด์ชนิดต่าง
ๆ
ส่วนการเกิดปฏิกิริยาในรูปแบบ
(ข)
(รูปที่
๔)
นั้นขึ้นอยู่กับว่า
Nu
สามารถเข้าถึงอะตอม
C
ที่มีอะตอมฮาโลเจนเกาะอยู่ได้ง่ายหรือยาก
ตรงนี้จะมีเรื่องขนาดของหมู่อื่นที่เกาะอยู่กับอะตอม
C
ตัวดังกล่าวเข้ามาเกี่ยวข้อง
กล่าวคือถ้าหมู่อื่นที่ไม่ใช่อะตอมฮาโลเจนนั้นมีขนาดเล็ก
(เช่นเป็นอะตอม
H)
Nu ก็จะเข้าถึงอะตอม
C
ตัวดังกล่าวได้ง่าย
การเกิดปฏิกิริยาในรูปแบบนี้ก็จะเกิดได้ง่าย
แต่ถ้าหมู่อื่นที่มาเกาะกับอะตอม
C
ตัวดังกล่าวมีขนาดใหญ่หรือเป็นหมู่ที่มีกิ่งก้าน
การเกิดปฏิกิริยาในรูปแบบนี้ก็จะเกิดได้ยาก
และถ้าตัว Nu
เองก็มีขนาดใหญ่ร่วมด้วยแล้ว
การเกิดปฏิกิริยารูปแบบนี้ก็อาจจะเกิดไม่ได้เลย
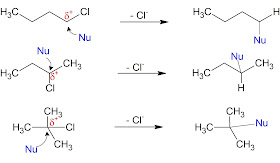
รูปที่
๔ การเข้าทำปฏิกิริยาที่ตำแหน่งอะตอม
C
ที่มีความเป็นขั้วบวกของ
Nucleophile
เหตุผลที่กล่าวมาข้างต้นเป็นตัวอธิบายว่าทำไมสารประกอบอัลคิลเฮไลด์ชนิด
1º
จึงเกิดปฏิกิริยาในรูปแบบนี้ได้ง่ายกว่าชนิด
2º
และชนิด
2º
ก็เกิดได้ง่ายกว่าชนิด
3º
(ลำดับกลับกับรูปแบบ
(ก))
จากการที่อัตราการเกิดปฏิกิริยาขึ้นอยู่กับการชนกันระหว่างโมเลกุลสารประกอบอัลคิลเฮไลด์กับ
Nu
อัตราการเกิดปฏิกิริยาจึงขึ้นอยู่กับความเข้มข้นของสารตั้งต้นทั้งสอง
อัตราการเกิดปฏิกิริยาจึงเป็นปฏิกิริยาอันดับสอง
(2nd
order reaction) หรือเขียนย่อว่า
SN2
เอริลเฮไลด์มีพฤติกรรมที่แตกต่างไปจากอัลคิลเฮไลด์มาก
ในขณะที่อัลคิลเฮไลด์เกิดปฏิกิริยา
nucleophilic
substitution ได้ง่าย
เอริลเฮไลด์กลับเกิดปฏิกิริยาดังกล่าวได้ยากมาก
ต้องใช้อุณหภูมิและความดันที่สูงช่วยทำให้เกิด
สาเหตุก็เพราะอิเล็กตรอนคู่โดดเดี่ยวของอะตอมฮาโลเจนสามารถเกิด
resonance
กับ
pi
elelctron ของวงแหวนเบนซีน
ประจุจึงกระจายตัวออกไป
และพันธะ C-X
ของเอริลเฮไลด์ก็ยังสั้นกว่าพันธะ
C-X
ของอัลคิลเฮไลด์
แสดงให้เห็นว่าดังกล่าวเป็นพันธะที่ก้ำกึ่งระหว่างพันธะเดี่ยวและพันธะคู่
(รูปที่
๕)
รูปที่
๕ การเกิด resonance
ของคลอโรเบนซีน
แต่มีการค้นพบว่าถ้าหากสารประกอบอัลคิลเฮไลด์มีหมู่ที่สองที่เป็นหมู่ดึงอิเล็กตรอนออกจากวงแหวน
(electron
withdrawing group) มาเกาะอยู่ที่ตำแหน่ง
ortho
หรือ
para
เมื่อเทียบกับตำแหน่งของอะตอมฮาโลเจน
การแทนที่อะตอมฮาโลเจนด้วย
Nu
จะเกิดได้ง่ายขึ้น
ดังตัวอย่างที่แสดงในรูปที่
๖ ข้างล่าง
ตรงนี้ขอให้พึงสังเกตตำแหน่งของประจุลบที่เกิดขึ้นในระหว่างการเกิด
resonance
ไปรอบวงแหวนเบนซีนในรูปที่
๕ จะเห็นว่าจะประจุลบจะอยู่ที่ตำแหน่ง
ortho
หรือ
para
เมื่อเทียบกับอะตอมฮาโลเจนเช่นกัน
การที่มีหมู่ดึงอิเล็กตรอนเข้าไปเกาะที่ตำแหน่งดังกล่าว
จึงเป็นเหมือนกับไปรบกวนการเกิด
resonance
รูปที่
๖ ปฏิกิริยา nucleophilic
substitution อะตอม
Cl
ด้วย
NH3
จะเกิดได้ง่ายมากขึ้นเมื่อมีหมู่ไนโตร
(-NO2)
มาเกาะที่ตำแหน่ง
ortho
และ/หรือ
para
ถ้ามีหมู่ดึงอิเล็กตรอนมาเกาะที่ตำแหน่งดังกล่าวมากขึ้น
การเกิดปฏิกิริยาก็จะเกิดได้ง่ายมากขึ้นตามไปด้วย
-
การสังเคราะห์
1,3,5-Triamine-2,4,6-trinitrobenzene
1,3,5-Triamine-2,4,6-trinitrobenzene
เป็นสารประกอบที่จัดอยู่ในกลุ่ม
Insensitive
High Explosive (IHE) หรือวัตถุระเบิดแรงสูงที่ไม่ว่องไว
กล่าวคือเป็นวัตถุระเบิดที่จุดระเบิดได้ยาก
ไม่ระเบิดได้ง่ายจากการกระแทกอย่างรุนแรง
วัตถุระเบิดดังกล่าวถูกนำไปใช้ในอาวุธบางประเภทที่ต้องการให้หัวรบเจาะเกราะป้องกันเข้าไปให้ได้ก่อน
โดยที่หัวรบต้องไม่ระเบิด
แล้วค่อยไประเบิดภายใน
(เช่นกระสุนปืนใหญ่เจาะเกราะที่เรือรบใช้ในการยิงต่อสู้กับเรือรบด้วยกัน)
นอกจากนี้ยังมีการนำไปใช้กับอาวุธบางชนิดที่ต้องการความปลอดภัยสูง
ไม่ระเบิดได้ง่ายแม้ว่าจะได้รับแรงกระแทกที่รุนแรง
เว้นแต่ว่าจะได้รับการจุดระเบิดด้วยวิธีการที่เหมาะสม
ตัวอย่างของอาวุธดังกล่าวได้แก่ระเบิดนิวเคลียร์ที่ทิ้งจากเครื่องบินรบ
ที่ต้องการความมั่นใจว่าถ้าหากเกิดอุบัติเหตุใด
ๆ ที่ทำให้เครื่องบินบรรทุกระเบิดนิวเคลียร์ดังกล่าวตก
ระเบิดนิวเคลียร์จะต้องไม่ระเบิด
(ระเบิดนิวเคลียร์นั้นใช้ดินระเบิดสร้าง
explosive
lens
เป็นตัวผลักดันให้เชื้อเพลิงยูเรเนียมหรือพลูโตเนียมที่แยกชิ้นกันอยู่นั้นประกบเข้าด้วยกัน)
รูปที่
๗ ตัวอย่างเส้นทางที่เป็นไปได้ในการสังเคราะห์
1,3,5-Triamine-2,4,6-trinitrobenzene
รูปที่
๗ ข้างบนแสดงตัวอย่างเส้นทางหนึ่งที่เป็นไปได้ในการสังเคราะห์
1,3,5-Triamine-2,4,6-trinitrobenzene
โดยเริ่มจากเบนซีน
เริ่มจากปฏิกิริยา nitration
เบนซีนให้กลายเป็น
nitrobenzene
(ใช้
H2SO4
เป็นตัวเร่งปฏิกิริยา)
จากนั้นจึงทำการรีดิวซ์หมู่
-NO2
ให้กลายเป็น
-NH2
ก่อนที่จะทำปฏิกิริยา
chlorination
เหตุผลที่ต้องเปลี่ยนหมู่
-NO2
เป็น
-NH2
ก่อนก็เพราะหมู่
-NH2
เป็น
ring
activating group ที่แรง
ทำให้การแทนที่อะตอม H
ที่เหลืออยู่ของวงแหวนเกิดได้ง่ายมากขึ้น
(ถ้าเป็นโมเลกุลเบนซีนปรกติ
การเกิดปฏิกิริยา chlorination
จะเกิดได้ยาก)
และยังทำให้เกิดการแทนที่ที่ตำแหน่ง
ortho
และ
para
ขั้นตอนถัดไปเป็นการออกซิไดซ์หมู่
-NH2
กลับเป็นหมู่
-NO2
ก่อนทำปฏิกิริยา
nitration
เพื่อแทนที่อะตอม
H
ที่เหลือของวงแหวนด้วยหมู่
-NO2
จากนั้นจึงค่อยแทนที่อะตอม
Cl
ด้วยหมู่
-NH2
(1,3,5-trichloro-2,4,6-trinitrobenzene มีหมู่
-NO2
ซึ่งเป็นหมู่ดึงอิเล็กตรอนอยู่ที่ตำแหน่ง
ortho
และ
para
เมื่อเทียบกับตำแหน่งอะตอม
Cl)
ที่น่าสนใจก็คือสามารถทำปฏิกิริยา
nitration
กับ
2,4,6-trichloroaniline
ได้โดยตรงหรือไม่
แล้วค่อยออกซิไดซ์หมู่ -NH2
ให้กลายเป็น
-NO2
เพราะแม้ว่าปรกติหมู่
-NH2
จะเป็น
ortho
และ
para
direction group แต่ในสภาวะของปฏิกิริยา
nitration
ที่ใช้กรดแก่ในการทำปฏิกิริยาและเป็นตัวเร่งปฏิกิริยา
หมู่ -NH2
จะแสดงฤทธิ์เป็นเบสและรับเอา
H+
เข้ามา
กลายเป็นหมู่ -NH3+
ซึ่งเป็น
electron
withdrawing group และเป็น
meta
directing group
ถ้าเป็นเช่นนี้เส้นทางการทำปฏิกิริยาก็จะกลายเป็นการนำเอา
2,4,6-Trichloroaniline
มาทำปฏิกิริยา
nitration
ก่อน
จากนั้นจึงค่อยทำการออกซิไดซ์หมู่
-NH2
ให้กลายเป็น
NO2
เรื่องการทำปฏิกิริยาของ
aniline
นี้เคยเล่าไว้ครั้งหนึ่งใน
Memoir
ปีที่
๘ ฉบับที่ ๑๐๗๑ วันศุกร์ที่
๓๑ ตุลาคม ๒๕๕๘ เรื่อง "จาก Alkanes ไปเป็น Aramids"
ปิดท้ายที่ว่างที่เหลือของหน้าด้วยภาพบรรยากาศการทำแลปเคมีของนิสิตวิศวกรรมเคมีปี
๒ เรื่องการไทเทรตกรด-เบสเมื่อบ่ายวันนี้ก็แล้วกันครับ
แหล่งข้อมูลประกอบการเขียน
๑.
Robert T. Morrison และ
Robert
N. Boyd, "Organic chemistry", 3rd ed., Prentice-Hall of
India, 1976.
๒.
Robert C. Atkins, Francis A. Carey และ
Chi
Wi Ong, "Organic chemistry : A brief course", McGraw Hill,
2013.







ไม่มีความคิดเห็น:
แสดงความคิดเห็น
หมายเหตุ: มีเพียงสมาชิกของบล็อกนี้เท่านั้นที่สามารถแสดงความคิดเห็น