เนื้อหาในบันทึกฉบับนี้อิงมาจากบทความเรื่อง
"Infrared
spectrometric studies of the surface basicity of metal oxides and
zeolites using adsorbed probe molecules" โดย
J.C.
Lavalley ตีพิมพ์ในวารสาร
Catalysis
Today vol. 27 ปีค.ศ.
1996 หน้า
377-401
โดยได้คัดมาเพียงแค่บางประเด็นเท่านั้น
ความเป็นเบสตามนิยามของ
Lewis
นั้นคือสารที่ให้คู่อิเล็กตรอน
ถ้าว่ากันตามนี้ก็คือไอออนลบนั่นเอง
และในกรณีของสารประกอบโลหะออกไซด์
ไอออนลบดังกล่าวก็ได้แก่
O2-
(ถ้าเป็นซัลไฟด์ก็จะเป็น
S2-)
ตามนิยามของ
Arrhenius
นั้น
เบสคือสารที่แตกตัวในน้ำแล้วให้ไอออนไฮดรอกไซด์
(hydroxide
OH-) และไอออนนี้ก็ถือว่าเป็นเบสตามนิยามของ
Brönsted
ด้วยเพราะมันสามารถรับโปรตอนได้
หมู่ไฮดรอกซิล
(hydroxyl
-OH) แตกต่างจากไอออนไฮดรอกไซด์อยู่ตรงที่
เรามองพันธะระหว่างอะตอม
O
กับอะตอมโลหะอีกตัวหนึ่งว่าเป็นอย่างไร
ถ้าเรามองว่าอะตอมโลหะนั้นสูญเสียอิเล็กตรอนไปให้อะตอม
O
(แบบไปแล้วไปลับ)
พันธะระหว่างอะตอมโลหะและอะตอม
O
ก็จะเป็นพันธะไอออนิก
หมู่ไฮดรอกซิลก็จะกลายเป็นหมู่ไฮดรอกไซด์
แต่ในกรณีที่ผลต่างระหว่างค่าอิเล็กโทรเนกาทิวิตี
(electronegativity)
ระหว่างอะตอมโลหะและอะตอม
O
นั้นไม่สูงมาก
เราก็สามารถมองได้ว่าพันธะระหว่างอะตอมโลหะและอะตอม
O
นั้นเป็นพันธะผสมระหว่างพันธะไอออนิกและพันธะโควาเลนซ์
ส่วนที่ว่าจะมีสัดส่วนความเป็นไอออนิก
(Percentage
ionic character)
มากน้อยแค่ไหนนั้นก็ขึ้นอยู่กับผลต่างของค่าอิเล็กโทรเนกาทิวิตี
ถ้าค่าผลต่างดังกล่าวมากเราก็สามารถมองได้ว่าอิเล็กตรอนของโลหะนั้นยกให้อะตอม
O
ไปเลย
ทำให้หมู่ไฮดรอกซิลกลายเป็นไอออนไฮดรอกไซด์
แต่ถ้าผลต่างมีค่าไม่มากก็สามารถมองได้ว่าอิเล็กตรอนของอะตอมโลหะนั้นใช้เวลาส่วนใหญ่ไปอยู่ที่อะตอม
O
มากกว่าที่ตัวอะตอมโลหะเอง
ซึ่งในกรณีหลังนี้อาจต้องมองอะตอม
O
ของหมู่ไฮดรอกซิลนั้นเป็นเบส
Lewis
ในขณะเดียวกันหมู่ไฮดรอกซิลเองยังแสดงฤทธิ์เป็นกรด
Brönsted
ได้ด้วย
ด้วยการที่มันจ่าย H+
ออกไปและทิ้งประจุลบเอาไว้ที่อะตอม
O
ความเป็นกรดของหมู่ไฮดรอกซิลนี้จะแรงขึ้นถ้าหากไอออนบวกที่เกาะกับอะตอม
O
อยู่นั้นสามารถสะเทินอิเล็กตรอนส่วนเกินที่เกิดขึ้นนี้ได้ด้วยการดึงเอาอิเล็กตรอนส่วนเกินตัวนี้ออกไป
ไอออนบวกที่มีความหนาแน่นประจุสูง
(คือเป็นไอออนขนาดเล็กและ/หรือมีประจุบวกมาก)
จะทำหน้าที่ดึงอิเล็กตรอนออกได้ดี
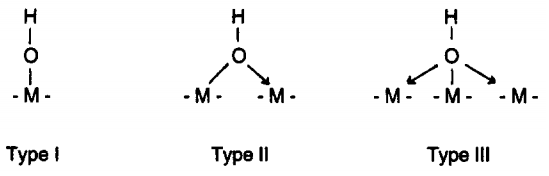
รูปที่
๑ แบบจำลองโครงสร้างของหมู่
-OH
บนพื้นผิวของแข็ง
Lavalley
ได้ยกตัวอย่างโครงสร้างหมู่
-OH
บนพื้นผิวสารประกอบโลหะออกไซด์
(เช่น
alumina
แล
chromia)
ดังแสดงในรูปที่
๑ ในกรณีของ Type
I ที่หมู่
-OH
มีไอออนโลหะ
M
อยู่เคียงข้างเพียงไอออนเดียว
ความเป็นเบสของหมู่ -OH
จะมากที่สุด
แต่เมื่ออะตอม O
ของหมู่
-OH
มีไอออนโลหะ
M
อยู่เคียงข้างมากขึ้น
(มี
coordination
number สูงขึ้นดังเช่นกรณีของ
Type
II และ
Type
III) ความเป็นเบสของหมู่
-OH
จะลดลงในขณะที่ความเป็นกรด
Brönsted
จะโดดเด่นขึ้นแทน
เพราะไอออนโลหะ M
(ที่มีประจุบวกนั้น)
จะช่วยดึงอิเล็กตรอนส่วนเกินที่อะตอม
O
ออกเมื่ออะตอม
O
ดังกล่าวจ่าย
H+
ออกไป
ทำให้ O-
ที่เกิดขึ้นนั้นมีเสถียรภาพมากขึ้น
Lavalley
ยังได้กล่าวไว้ว่าการเปลี่ยนแปลงความแรงของความเป็นเบสดังกล่าวเห็นได้จากการให้ตัวอย่างดูดซับแก๊สคาร์บอนมอนอกไซด์
(carbon
monoxide CO) ที่อุณหภูมิต่ำ
ที่พบว่าในกรณีโครงสร้างหมู่
-OH
แบบ
Type
I นั้น
เลขคลื่นการสั่น (ที่วัดด้วยเทคนิค
infrared
spectroscopy) ไม่ได้รับผลกระทบจาก
CO
ในขณะที่รูปแบบ
Type
II และ
Type
III นั้นตรวจพบการเกิดพันธะไฮโดรเจน
-OH
--- CO ระหว่างอะตอม
H
ของหมู่ไฮดรอกซิลกับอะตอม
C
ของโมเลกุล
CO
ส่วนในกรณีของโครงสร้างแบบ
Type
I นั้นก็มีรายงานว่าสามารถเกิดเป็นฟอร์เมต
(formate)
กับ
CO
(รูปที่
๒)
รูปที่
๒ การเกิดฟอร์เมต (formate)
สปีชีย์เมื่ออะตอม
O
ของหมู่
-OH
แสดงคุณสมบัติ
nucleophilic
(โมเลกุล
CO
นั้นด้านอะตอม
C
จะมีความเป็นขั้วบวกในขณะที่ด้านอะตอม
O
จะมีความเป็นขั้วลบ
ดังนั้นด้านอะตอม C
จะมีคุณสมบัติเป็น
electrophilic
คือมองหาตำแหน่งที่มีอิเล็กตรอนมากเช่นอะตอม
O
ของหมู่
-OH
ส่วนด้านอะตอม
O
นั้นจะมีคุณสมบัติที่เป็น
nucleophilic
คือมองหาตำแหน่งที่มีความเป็นบวกเช่นอะตอม
H
ของหมู่
-OH
ในกรณีของหมู่
-OH
ชนิด
Type
II และ
Type
III นั้น
เราอาจมองได้ว่าอะตอม O
ของหมู่
-OH
นั้นถูกไอออน
M
ของโลหะที่มีอยู่หลายไอออนดึงเอาอิเล็กตรอนออกไป
ทำให้ความหนาแน่นอิเล็กตรอนที่อะตอม
O
ลดลง
แต่ผลการดึงดังกล่าวทำให้อะตอม
H
นั้นมีความเป็นบวกมากขึ้นจนทำให้สามารถสร้างพันธะไฮโดรเจนกับอะตอม
O
ของ
CO
ได้
ส่วนในกรณีของ Type
I นั้นยิ่งถ้าไอออน
M
มีความหนาแน่นประจุต่ำและมีค่าอิเล็กโทรเนกาทิวิตีที่ต่ำด้วยแล้ว
จะทำให้อะตอม O
ของหมู่
-OH
มีความหนาแน่นอิเล็กตรอนที่สูง
อะตอม C
ของ
CO
จึงหันเข้ามากับกับอะตอม
O
ของหมู่
-OH)
รูปที่
๓ การยึดเกาะของโมเลกุล
CO
กับไอออน
O2-
ที่เป็นเบส
Lewis
ที่นำไปสู่การเกิดเป็นไอออนคาร์บอไนท์
(carbonite
CO22-)
โมเลกุล
CO
ในเฟสแก๊สนั้นยังสามารถเกิดการดูดซับที่ไอออนบวก
(cation)
หรือตำแหน่งที่เป็นกรด
Lewis
โดยการดูดซับที่ตำแหน่งดังกล่าวจะทำให้เลขคลื่นการสั่นของโมเลกุล
CO
ในเฟสแก๊สที่เดิมอยู่ที่
2143
cm-1 ย้ายไปยังเลขคลื่นที่สูงขึ้นตามความแรงของตำแหน่งกรด
Lewis
นั้น
แต่ที่อุณหภูมิต่ำ (100
K) ตัวโมเลุกล
CO
เองก็สามารถเกิดการดูดซับกับไอออน
O2-
ที่เป็นเบส
Lewis
เกิดเป็นไอออนคาร์บอไนท์
(carbonite
CO22-) ได้ดังแสดงในรูปที่
๓
คาร์บอนไดออกไซด์
(carbon
dioxide CO2)
เป็นแก๊สที่นิยมใช้กันมากกว่าในการวัดความเป็นเบสของพื้นผิวด้วยการที่มันมีความเป็นกรด
โดยเฉพาะอย่างยิ่งในกรณีของหมู่
-OH
ชนิด
Type
I ที่
1
หมู่จะจับกับโมเลกุล
CO2
1 โมเลกุลเกิดเป็นสปีชีย์ไฮโดรเจนคาร์บอนเนต
(hydrogen
carbonate) ดังแสดงในรูปที่
๔
รูปที่
๔ การดูดซับโมเลกุล CO2
ณ
ตำแหน่งหมู่ไฮดรอกซิล -OH
เกิดเป็นสปีชีย์ไฮโดรเจนคาร์บอนเนต
(hydrogen
carbonate)
ส่วนในกรณีของ
O2-
ที่เป็นเบส
Lewis
นั้นจากการศึกษาทางด้าน
infrared
spectroscopy พบว่าโมเลกุล
CO2
มีการเกาะได้หลายรูปแบบ
(รูปที่
๕)
โดยอะตอม
C
นั้นจะเข้าไปยึดเกาะกับ
O2-
ในขณะที่อะตอม
O
อีก
2
อะตอมของโมเลกุล
CO2
อาจอยู่อย่างอิสระหรือหนึ่งในนั้นมีการยึดเกาะกับไอออนบวก
M
ที่อยู่เคียงข้าง
(และสามารถเข้าถึงได้)
รูปที่
๕ รูปแบบต่าง ๆ ของการเกาะของโมเลกุล
CO2
บนตำแหน่ง
O2-
ที่เป็นเบส
Lewis
Pyrrole
เป็นโมเลกุลสารอินทรีย์ตัวหนึ่งที่สามารถนำมาใช้วัดความเป็นเบสบนพื้นผิวโลหะออกไซด์ได้โดยทำหน้าที่เป็นสารที่จ่ายโปรตอน
ดังกรณีของ O2-
ที่แสดงในรูปที่
๖ ข้างล่าง ถ้าหาก O2-
มีความเป็นเบสที่ไม่แรง
โมเลกุล pyrrole
ก็ทำได้เพียงแค่การสร้างพันธะไฮโดรเจนยึดเกาะกับ
O2-
นั้น
(ที่อาจกำจัดได้ด้วยการทำสุญญากาศ)
แต่ถ้า
O2-
มีความเป็นเบสที่แรง
อะตอม N
ของโมเลกุล
pyrrole
ก็อาจจ่ายโปรตอนให้กับ
O2-
แล้วกลายเป็น
pyrrolate
ion (ที่อาจต้องไล่ออกจากพื้นผิวด้วยการให้ความร้อน)
รูปที่
๖ รูปแบบการยึดเกาะของโมเลกุล
pyrroloe
เข้ากับ
O2-
รูปที่
๗ และ ๘ เป็น IR
spectra ที่นำมาจากรูปที่
๕.๔
และ ๕.๗
ในวิทยานิพนธ์ปริญญาวิศวกรรมศาสตร์มหาบัณฑิต
วิศวกรรมเคมี จุฬาลงกรณ์มหาวิทยาลัย
ปีการศึกษา ๒๕๔๓ เรื่อง
"การศึกษาการวัดความเป็นเบสของพื้นผิวตัวเร่งปฏิกิริยาด้วยการดูดซับโมเลกุลโพรบ"
ของนางสาวจีราพร
จันทรศร โดยเป็นการศึกษาการใช้
pyrrole
วัดความเป็นเบสของพื้นผิว
ในการทดลองนี้ได้ให้ MgO
ดูดซับโมเลกุล
pyrrole
เอาไว้ก่อน
จากนั้นจึงใช้การทำสุญญากาศเพื่อกำจัดโมเลกุล
pyrrole
ที่ไม่สามารถสร้างพันธะที่แข็งแรงยึดเกาะพื้นผิวเอาไว้ได้
(รูปที่
๗)
ส่วนรูปที่
๘ เป็นการทดลองต่อจากรูปที่
๗ กล่าวคือหลังจากทำสุญญากาศจนพบว่าพีคของ
pyrrole
นั้นลดต่ำลงจนคงที่แล้ว
ก็ทำการเพิ่มอุณหภูมิตัวอย่างเป็นขั้น
ๆ และทำการวัดปริมาณ pyrrole
ที่หลงเหลืออยู่บนพื้นผิว
จะเห็นว่าพอเพิ่มอุณหภูมิไปได้แค่
100ºC
ก็ไม่สามารถตรวจพบ
pyrrole
บนพื้นผิวแล้ว
รูปที่
๗ IR
spectra การดูดซับ
pyrrole
บนพื้นผิว
MgO
หลังจากที่ให้พื้นผิวดูดซับ
pyrrole
จนอิ่มตัวและทำสุญญากาศที่อุณหภูมิห้องเพื่อกำจัดโมเลกุล
pyrrole
ส่วนเกินออก
(ตำแหน่งเลขคลื่น
1016
cm-1)
รูปที่
๘ IR
spectra การดูดซับ
pyrrole
บนพื้นผิว
MgO
หลังจากกำจัดโมเลกุล
pyrrole
ส่วนเกินออกด้วยการทำสุญญากาศที่อุณหภูมิห้อง
จากนั้นจึงค่อยเพิ่มอุณหภูมิตัวอย่างและวัดปริมาณที่หลงเหลืออยู่บนพื้นผิว







ไม่มีความคิดเห็น:
แสดงความคิดเห็น