ไม่บ่อยครั้งนักที่จะได้เห็นการวิจัยค้นหาตัวเร่งปฏิกิริยาที่มีความว่องไวในการทำปฏิกิริยา
"ลดต่ำลง"
กว่าของเดิม
ในยุคสมัยที่ถ่านหินยังเป็นแหล่งวัตถุดิบสำหรับสำหรับสารประกอบไฮโดรคาร์บอนไม่อิ่มตัวโมเลกุลเล็กและอะโรมาติก
สารประกอบไฮโดรคาร์บอนไม่อิ่มตัวโมเลกุลเล็กตัวหนึ่งที่ได้รับความสนใจอย่างแพร่หลายว่าจะเอาไปใช้ประโยชน์ใดได้บ้างเห็นจะได้แก่อะเซทิลีน
(Acelylene
C2H2)
พันธะสาม
(triple
bond) ระหว่างอะตอมคาร์บอนนั้น
มีความสามารถในการทำปฏิกิริยาต่าง
ๆ คล้ายคลึงกับพันธะคู่
(double
bond) ระหว่างอะตอมคาร์บอน
แม้ว่าในบางกรณีจะมีความแตกต่างกันอยู่บ้าง
ปฏิกิริยาหนึ่งที่สามารถเกิดได้คือ
Electrophilic
addition ทั้งนี้เพราะบริเวณพันธะสามนั้นมีอิเล็กตรอนอยู่หนาแน่น
จึงเป็นตำแหน่งดึงดูดให้สารที่ต้องการอิเล็กตรอนเข้ามาทำปฏิกิริยา
และปฏิกิริยาหนึ่งที่จะยกมาเล่าในวันนี้คือปฏิกิริยาระหว่าง
C2H2
กับ
arsenic
trichloride (AsCl3)
รูปที่
๑ ปฏิกิริยาระหว่าง C2H2
กับ
arsenic
trichloride (AsCl3) ได้
Chlorovinyldichloroarsine
(L-1)
ปฏิกิริยานี้ถูกค้นพบโดยบังเอิญในปีค.ศ.
๑๙๐๔
โดยผลิตภัณฑ์ที่ได้คือ
Chlorovinyldichloroarsine
(รูปที่
๑)
ที่เป็นสารที่ระเหยกลายเป็นไอได้ง่าย
แต่มีพิษที่รุนแรง
(เรียกว่าคนค้นพบโดยบังเอิญต้องเข้านอนโรงพยาบาลไปหลายวัน)
และอันที่จริง
AsCl3
ยังสามารถทำปฏิกิริยากับ
C2H2
ได้ต่อไปได้ถึง
3
โมเลกุล
(รูปที่
๒)
รูปที่
๒ Dichlorovinylchloroarsine
(L-2) และ
Trichlorovinylarsine
(L-3) ที่เกิดจากการทำปฏิกิริยาระหว่าง
AsCl3
กับโมเลกุล
C2H2
จำนวน
2
และ
3
โมเลกุลตามลำดับ
ต่อมาในช่วงสงครามโลกครั้งที่
๑
ก็ได้มีการปัดฝุ่นหาวิธีการผลิตสารนี้ในปริมาณมากกันใหม่เพื่อใช้เป็นอาวุธเคมี
(อยู่ในกลุ่ม
Vesicant
หรือ
Blister
agent ที่ทำให้ผิวหนังไหม้เป็นแผลพุพองเช่นเดียวกับแก๊สมัสตาร์ด
แต่ตัวนี้ยังมี As
เข้าไปทำลายการทำงานของระบบประสาทด้วย)
จนประสบความสำเร็จในปีค.ศ.
๑๙๑๘
ภายใต้ชื่อ Lewisite
หรือ
L-1
(เอาชื่อผู้คิดค้นกระบวนการคือ
Lewis
มาตั้งเป็นชื่อสาร
แต่เป็นคนละคนกับคนที่นำเสนอทฤษฎีกรด-เบสนะ)
แต่ก็ไม่ได้ถูกนำมาใช้งาน
เพราะสงครามจบเสียก่อน
คือผลิตในอเมริกา แต่พอขนมาถึงยุโรป
สงครามก็สิ้นสุดพอดี
เขาก็เลยเอาไปทิ้งทะเล
(เรื่องปรกติที่ประเทศมหาอำนาจเขาทำกันเวลาที่ไม่รู้ว่าจะจัดการกับสารพิษอย่างไร)
ใครสนใจก็ไปอ่านเรื่องราวต่าง
ๆ เพิ่มเติมได้ที่
https://en.wikipedia.org/wiki/Lewisite
หรือไม่ก็ที่
http://www.ncbi.nlm.nih.gov/books/NBK201338/
อันที่จริง
Chlorovinyldichloroarsine
นี้มีสองไอโซเมอร์
ขึ้นอยู่กับว่าตำแหน่งอะตอม
Cl
นั้นอยู่ฟากเดียวกัน
(cis
- isomer) หรืออยู่คนละฟาก
(trans
- isomer) กับหมู่
AsCl2
แต่เมื่ออยู่ในรูปสารละลายในน้ำ
ตัว cis
- isomer สามารถเกิดปฏิกิริยา
photoconversion
ไปเป็น
trans
- isomer ได้
อันที่จริงการเรียกไอโซเมอร์แบบ
cis
หรือ
trans
นั้นมันใช้กับไฮโดรคาร์บอนเป็นหลัก
แต่สงสัยว่าสมัยนั้นยังไม่มีการกำหนดการเรียกแบบ
E-Z
notation ที่ครอบคลุมหมู่อื่นที่ไม่ใช่ไฮโดรคาร์บอน
ก็เลยอนุโลมใช้การเรียกชื่อแบบนี้ไปก่อน
รูปที่
๓ สิทธิบัตรประเทศสหรัฐอเมริกาวิธีการผลิต
Lewisite
ปฏิกิริยาระหว่าง
C2H2
กับ
AsCl3
ไม่ได้เกิดได้ง่าย
จำเป็นต้องมีตัวเร่งปฏิกิริยาที่เป็นกรดช่วย
และตัวเร่งปฏิกิริยาในยุคแรกที่ใช้กันก็คือ
AlCl3
แต่มีความว่องไวสูงเกินไป
AlCl3
ทำให้เกิดปฏิกิริยาข้างเคียงและผลิตภัณฑ์ต่าง
ๆ ที่ไม่ต้องการ อันที่จริงแม้ว่า
Dichlorovinylchloroarsine
(L-2) และ
Trichlorovinylarsine
(L-3) จะมีความเป็นพิษที่ร้ายแรงเช่นเดียวกันกับ
Chlorovinyldichloroarsine
(L-1) แต่สารสองตัวนี้มีจุดเดือดสูง
ระเหยกลายเป็นไอได้น้อย
จึงไม่ค่อยเป็นที่ต้องการสำหรับการนำไปใช้เป็นอาวุธ
(เขาต้องการสารที่กลายเป็นไอได้ง่าย)
ด้วยเหตุนี้จึงมีการวิจัยหาตัวเร่งปฏิกิริยาที่เหมาะสม
(คือมีความว่องไวน้อยกว่า
AlCl3
แต่ต้องไม่ต่ำมากเกินไป)
และในที่สุดก็ประสบความสำเร็จโดยได้นำไปจดสิทธิบัตรในประเทศสหรัฐอเมริกา
(เลขที่
2,466,834)
ในปีค.ศ.
๑๙๔๙
(รูปที่
๓)
ถ้าอยากรู้ว่าตัวเร่งปฏิกิริยาที่ค้นพบใหม่นั้นคือสารใดก็ลองตามอ่านได้จากสิทธิบัตรดังกล่าวเอาเอง
(ค้น
google
ดูก็ได้)
สิทธิบัตรแบบนี้แปลกดีตรงที่มีการระบุเอาไว้อย่างชัดเจนตอนเริ่มเรื่องโดยว่ารัฐบาลสามารถนำไปใช้ได้โดยไม่ต้องจ่ายเงินค่าลิขสิทธิ์
แต่จะว่าไปแล้วถ้าตอนนั้นมีคนขอซื้อเขาจะยอมขายเหรอ
แต่ถ้าถึงตอนนี้คงไม่มีปัญหาเรื่องการซื้อขายแล้วมั้ง
เพราะสิทธิบัตรหมดอายุไปตั้งนานแล้ว
กำมะถัน
(S)
เป็นธาตุที่อยู่ในหมู่เดียวกับออกซิเจน
(O)
และสารอินทรีย์ที่มีกำมะถันเป็นองค์ประกอบที่ปรากฏอยู่ตามธรรมชาติก็มีอยู่ไม่น้อย
แต่ก็แปลกที่เคมีเกี่ยวกับหมู่ฟังก์ชันที่มีกำมะถันเป็นองค์ประกอบมักไม่ค่อยปรากฏในตำราเคมีอินทรีย์
มีพอแทรกอยู่บ้างเล็กน้อยเช่นในบทแอลกอฮอล์
-OH
ก็มีการกล่าวถึงหมู่ไทออล
(thiol)
หรือ
-SH
บ้าง
ในตำราเคมีอินทรีย์จะบอกไว้ว่าเราสามารถเปลี่ยนหมู่
-OH
ให้กลายเป็นหมู่
-SH
ได้ด้วยการนำแอลกอฮอล์มาทำปฏิกิริยากับ
H2S
ในภาวะที่มีกรดเป็นตัวเร่งปฏิกิริยา
อ่านแล้วก็คงรู้สึกว่าคงไม่ยากอะไร
แต่ในความเป็นจริงนั้นในภาวะที่มีกรดเป็นตัวเร่งปฏิกิริยา
แอลกอฮอล์เองก็เกิดปฏิกิริยาอื่นได้เช่นกันไม่ว่าจะเป็น
dehydration
ในโมเลกุลของมันเองทำให้เกิดเป็นพันธะคู่
หรือระหว่างโมเลกุลของแอลกอฮอล์สองโมเลกุลกลายเป็นสารประกอบอีเทอร์
และเรื่องมันคงจะวุ่นขึ้นไปอีกถ้าหากแอลกอฮอล์ที่เป็นสารตั้งต้นนั้นมีหมู่
-OH
มากกว่าหนึ่งหมู่
แถมยังอยู่ในตำแหน่งที่ใกล้กันอีกเช่นในกรณีของกลีเซอรีน
(glycerine
หรือบางทีก็เรียกว่ากลีเซอรอล
glycerol)
หมู่
-SH
มีความเป็นกรดที่แรงกว่าหมู่
-OH
ดังนั้น
R-SH
จึงแตกตัวเป็น
R-S-
ได้ดีกว่า
R-OH
และในกรณีที่โมเลกุลนั้นมีหมู่ฟังก์ชัน
R-S-
จำนวนหลายหมู่
และหมู่นี้อยู่ใกล้กันหรือโมเลกุลสามารถบิดตัวจนหมู่นี้มาอยู่ใกล้กันได้
จึงทำให้สารประกอบเช่นนี้สามารถเกิดเป็นสารประกอบเชิงซ้อน
(complex)
ที่มีเสถียรภาพกับไอออนของโลหะได้
ตัวอย่างหนึ่งของสารนี้ที่พบเห็นและมีใช้กันทั่วไปในห้องปฏิบัติการคือ
Ethylene
diamine tetraacetic acid หรือ
EDTA
ที่ใช้ในการไทเทรตหาความกระด้างของน้ำ
ปัจจุบันเรามีกลีเซอรึน
(glycerine)
เป็นจำนวนมากที่เป็นผลพลอยได้จากการผลิตเมทิลเอสเทอร์จากน้ำมันปาล์ม
มีความพยายามหลากหลายที่จะนำเอากลีเซอรีนที่ได้นี้ไปเปลี่ยนเป็นผลิตภัณฑ์ที่มีมูลค่าเพิ่มสูงขึ้น
(แต่คงยากอยู่เหมือนกัน
เพราะกลีเซอรีนที่ได้จากกระบวนการผลิตเมทิลเอสเทอร์มีความบริสุทธิ์ไม่สูงนัก)
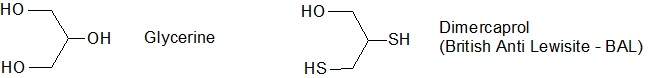
สารประกอบตัวหนึ่งที่มีโครงสร้างโมเลกุลคล้ายคลึงกับกลีเซอรีนคือ
2,3-dimercaptopropanol
โดยที่หมู่
-OH
ที่ปลายข้างหนึ่งและที่อยู่ตรงกลายสายโซ่ถูกแทนที่ด้วยหมู่
-SH
(รูปที่
๔)
รูปที่
๔ กลีเซอรีน (ซ้าย)
ประกอบด้วยหมู่
-OH
3 หมู่ด้วยกัน
ในขณะที่ Dimercaprol
ที่มีโครงสร้างโมเลกุลคล้ายคลึงกับกลีเซอรีนนั้นหมู่
-OH
ที่ปลายข้างหนึ่งและที่อยู่ตรงกลายสายโซ่ถูกแทนที่ด้วยหมู่
-SH
2,3-dimercaptopropanol
นี้มีชื่อเรียกอื่นที่เป็นที่รู้จักกันมากกว่าคือ
"Dimercaprol"
หรือ
"British
Anti Lewisite" ที่ย่อว่า
BAL
สารตัวนี้ได้รับการพัฒนาขึ้นมาในประเทศอังกฤษเพื่อใช้รักษาผู้ได้รับสาร
Lewisite
จนทำให้มีการถอน
Lewisite
จากคลังอาวุธเคมี
คงเป็นเพราะถ้ามันมียาแก้ก็ไม่รู้เหมือนกันว่าจะเก็บสารพิษนั้นเอาไว้ทำไม
ยา
Dimercaprol
ที่เป็นตัวที่ทำให้อาวุธเคมี
Lewisite
นั้นตกรุ่นไปมีการจดสิทธิบัตรวิธีการผลิตในประเทศสหรัฐอเมริกาเอาไว้ตั้งแต่ปีค.ศ.
๑๙๔๖
(รูปที่
๕)
หรือก่อนที่จะมีการจดสิทธิบัตรวิธีการผลิต
Lewisite
ถึง
๓ ปี ซึ่งก็นับว่าแปลกดีเหมือนกัน
แต่ Dimercaprol
ก็ยังคงมีการผลิตและใช้งานมาจวบจนถึงทุกวันนี้
โดยใช้เป็นยาในการรักษาอาการที่เกิดจากการได้รับโลหะหนักบางชนิดสะสมในร่างกายมากเกินไป
โดยตัวหมู่ -SH
ทั้งสองหมู่นั้นจะไปจับกับไอออนบวกของโลหะกลายเป็นสารประกอบเชิงซ้อนที่ละลายน้ำได้ทำให้สามารถขับออกจากร่างกายได้
รูปที่
๕ สิทธิบัตรการสังเคราะห์
Dimercaprol
อุตสาหกรรมหนึ่งที่มีความสัมพันธ์กันอย่างใกล้ชิดกับการผลิตอาวุธเคมีคืออุตสาหกรรมผลิตยาปราบศัตรูพืช
โดยเฉพาะยาฆ่าแมลง
เพียงแต่ตัวไหนมีความเป็นพิษที่สูงมากจนไม่เหมาะที่จะให้คนทั่วไปใช้งานได้ก็นำไปใช้เป็นอาวุธเคมี
ตัวไหนมีความเป็นพิษไม่แรงมากนัก
สลายตัวได้ง่าย
ก็ถูกนำมาจำหน่ายเป็นยาปราบศัตรูพืช
ปฏิกิริยาเคมีการผลิตและการทำให้บริสุทธิ์นั้นอาจดูเรียบง่าย
แต่การป้องกันไม่ให้เกิดการรั่วไหลและการจัดการกับผลิตภัณฑ์ที่ได้นั้นไม่ใช่เรื่องง่าย
เรียกว่าผู้ปฏิบัติงานผลิตสารก็มีความเสี่ยงสูงอยู่ในตัวเช่นกัน
ที่นำเรื่องนี้มาเล่าก็เพราะเห็นว่าแปลกดีที่มีการจดสิทธิบัตรสารที่ไม่มีการนำไปใช้ประโยชน์ในทางสร้างสรรใด
ๆ เว้นแต่เพื่อใช้เป็นอาวุธเพื่อทำลายล้างมนุษย์ด้วยกัน




ไม่มีความคิดเห็น:
แสดงความคิดเห็น