"... ตัวอย่างของปฏิกิริยาประเภทนี้ในงานทางวิศวกรรมเคมีได้แก่ปฏิกิริยา
partial
oxidation และ
thermal
cracking ไฮโดรคาร์บอน
ในปฏิกิริยา partial
oxidation นั้น
ไฮโดรคาร์บอนหรือสารอินทรีย์ตัวอื่นที่เป็นสารตั้งต้น
(A)
จะถูกออกซิไดซ์ด้วยออกซิเจนจากอากาศที่ป้อนเข้าไป
โดยมีตัวเร่งปฏิกิริยาช่วยเพื่อให้กลายเป็นผลิตภัณฑ์สารประกอบ
oxygenate
(B) แต่ทั้งนี้เวลาที่ใช้ในการออกซิไดซ์นั้นต้องเหมาะสม
คือไม่มากและไม่น้อยเกินไป
(ในกรณีของ
tubular
reactor เวลาที่ใช้ในการออกซิไดซ์ก็คือความยาวของตัว
reactor
หารด้วยความเร็วที่สารตั้งต้นไหลผ่าน)
ในกรณีของปฏิกิริยา
thermal
cracking นั้น
ไฮโดรคาร์บอนโมเลกุลใหญ่ที่เป็นสารตั้งต้นจะได้รับความร้อนจนโมเลกุลแตกออกเป็นโมเลกุลที่เล็กลง
ตัวอย่างของปฏิกิริยานี้ได้แก่การเปลี่ยนน้ำมันหนัก
(เช่นน้ำมันเตา)
ให้กลายเป็นน้ำมันเบา
(เช่น
เบนซินและดีเซล)
และการผลิตโอเลฟินส์
(เช่นเอทิลีนและโพรพิลีน)
ในกรณีที่เวลาที่ใช้ในการทำปฏิกิริยานั้นสั้นเกินไป
สารตั้งต้น (A)
ก็จะทำปฏิกิริยาไปได้ไม่มาก
อาจต้องมีการติดตั้งกระบวนการนำกลับ
(recycle)
เพื่อนำสารตั้งต้นที่เหลือนั้นมาใช้ใหม่
แต่ถ้าใช้เวลาในการทำปฏิกิริยานานเกินไป
ผลิตภัณฑ์หลักที่ต้องการ
(B)
จะมีการสลายตัวต่อไปเป็นผลิตภัณฑ์ที่ไม่ต้องการ
(C)
มากเกินไป
ทำให้เกิดการสูญเสีย
โดยในกรณีของปฏิกิริยา
partial
oxidation สาร
C
ก็คือ
CO2
ส่วนปฏิกิริยา
thermal
cracking นั้น
ในกรณีของการผลิตน้ำมันเบาที่ต้องการใช้เป็นเชื้อเพลิงเหลว
สาร C
ก็จะเป็นพวกโมเลกุลที่เป็นแก๊ส
(C1
- C5) และถ้าเป็นกระบวนการผลิตโอเลฟินส์
สาร C
ก็จะเป็นพวก
อะเซทิลีน (acetylene
C2H2) และมีเทน
(methane
CH4) เป็นต้น
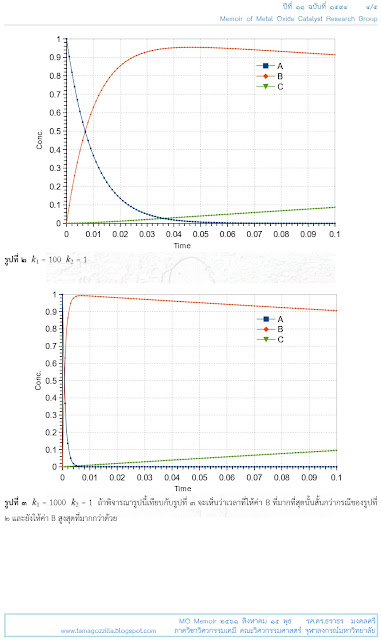
ในกรณีของปฏิกิริยาเหล่านี้
ณ อุณหภูมิหนึ่ง
ค่าคงที่ของการเปลี่ยนจาก
A
เป็น
B
(ค่า
k1)
จะมีค่าสูงกว่าค่าคงที่ของการเปลี่ยนจาก
B
เป็น
C
(ค่า
k2)
ดังนั้นคำถามที่มักเกิดขึ้นกับปฏิกิริยาเช่นนี้คือควรต้องใช้เวลาในการทำปฏิกิริยานานเท่าใด
จึงจะได้ B
มากที่สุด..."
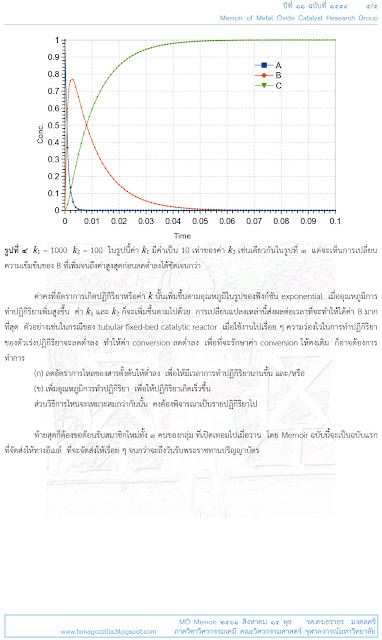
"... ค่าคงที่อัตราการเกิดปฏิกิริยาหรือค่า
k
นั้นเพิ่มขึ้นตามอุณหภูมิในรูปของฟังก์ชัน
exponential
เมื่ออุณหภูมิการทำปฏิกิริยาเพิ่มสูงขึ้น
ค่า k1
และ
k2
ก็จะเพิ่มขึ้นตามไปด้วย
การเปลี่ยนแปลงเหล่านี้ส่งผลต่อเวลาที่จะทำให้ได้ค่า
B
มากที่สุด
ตัวอย่างเช่นในกรณีของ
tubular
fixed-bed catalytic reactor เมื่อใช้งานไปเรื่อย
ๆ ความว่องไวในการทำปฏิกิริยาของตัวเร่งปฏิกิริยาจะลดต่ำลง
ทำให้ค่า conversion
ลดต่ำลง
เพื่อที่จะรักษาค่า conversion
ให้คงเดิม
ก็อาจต้องการทำการ
(ก)
ลดอัตราการไหลของสารตั้งต้นให้ต่ำลง
เพื่อให้มีเวลาการทำปฏิกิริยานานขึ้น
และ/หรือ
(ข)
เพิ่มอุณหภูมิการทำปฏิกิริยา
เพื่อให้ปฏิกิริยาเกิดเร็วขึ้น
ส่วนวิธีการไหนจะเหมาะสมกว่ากันนั้น
คงต้องพิจารณาเป็นรายปฏิกิริยาไป ..."
ท้ายสุดก็ต้องขอต้อนรับสมาชิกใหม่ทั้ง
๓ คนของกลุ่ม ที่เปิดเทอมไปเมื่อวาน
โดย Memoir
ฉบับนี้จะเป็นฉบับแรกที่จัดส่งให้ทางอีเมล์
ที่จะจัดส่งให้เรื่อย ๆ
จนกว่าจะถึงวันรับพระราชทานปริญญาบัตร



ไม่มีความคิดเห็น:
แสดงความคิดเห็น