บันทึกช่วยจำของกลุ่มวิจัยตัวเร่งปฏิกิริยาโลหะออกไซด์ บันทึกความจำของวิศวกรเคมีผู้ลงมือปฏิบัติ (mo.memoir@gmail.com)
วันจันทร์ที่ 23 เมษายน พ.ศ. 2561
การจำแนกตำแหน่งที่เป็นกรด Brönsted และ Lewis บนพื้นผิวของแข็งด้วยเทคนิค Infrared spectroscopy และ Adsorbed probe molecules MO Memoir : Monday 23 April 2561
วันอังคารที่ 19 กุมภาพันธ์ พ.ศ. 2556
MO ตอบคำถาม การวัดความเป็นกรด-เบสบนพื้นผิวของแข็ง MO Memoir : Tuesday 19 February 2556
เมื่อวันศุกร์ที่แล้วมีอีเมล์จากนักศึกษาสถาบันแห่งหนึ่งเขียนมาถามเรื่องการวัดความเป็นกรด-เบสของตัวเร่งปฏิกิริยาที่เป็นของแข็ง ซึ่งผมก็ได้ตอบอีเมล์เขาไปแล้ว แต่เห็นว่าจะเป็นประโยชน์สำหรับคนที่กำลังจะเริ่มทำการทดลองด้วย Memoir ฉบับนี้ก็เลยขอเอาเรื่องราวคำถาม-คำตอบดังกล่าวมาบันทึกไว้ โดยส่วนที่เป็นคำถามนั้นการแก้ไขเล็กน้อย แต่ส่วนที่เป็นคำตอบนั้นมีการเพิ่มคำอธิบายเพิ่มจากจากที่ได้ตอบทางอีเมล์ไป
ศุกร์ ๑๖ กุมภาพันธ์ พ.ศ. ๒๕๕๖
ขอบพระคุณเป็นอย่างสูง
TPD ในคำถามนี้คือเทคนิค Temperature Programmed Desorption ที่ใช้วิธีการให้ของแข็งดูดซับแก๊สเอาไว้จนอิ่มตัว จากนั้นก็เพิ่มอุณหภูมิให้กับของแข็งนั้นเพื่อให้แก๊สที่ดูดซับเอาไว้หลุดออกจากพื้นผิว เราจะใช้ข้อมูลความสัมพันธ์ระหว่างปริมาณแก๊สที่หลุดออกมา ณ อุณหภูมิต่าง ๆ เป็นตัวบ่งบอกคุณสมบัติของพื้นผิวของแข็งนั้น
การวัดความเป็นกรด-เบสบนพื้นผิวของแข็งก็ใช้หลักการเดียวกันกับการไทเทรตกรด-เบสที่เราเรียนกันมาตอน ม.ปลาย
เพียงแต่ว่าเวลาเราเรียนเคมีกันไม่ว่าจะเป็นตอนม.ปลายหรือพื้นฐานในมหาวิทยาลัย เราจะใช้กรด-เบสตามนิยามของ Brönsted ในการทำแลปเป็นหลัก และเรามักจะใช้กรด-เบสที่ละลายน้ำได้
แต่ถ้าเป็นกรณีของสารที่เป็นแก๊ส หรือในปฏิกิริยาเคมีอินทรีย์จำนวนมากนั้น การใช้นิยามของ Lewis จะทำให้มองเห็นภาพได้ชัดเจนมากกว่า
นิยามกรด-เบสของ Lewis คือกรดคือผู้ที่รับคู่อิเล็กตรอน ส่วนเบสคือผู้ที่ใช้คู่อิเล็กตรอน และด้วยนิยามของ Lewis นี้ทำให้บ่อยครั้งการมองว่าโมเลกุลไหนเป็นกรดหรือเบสนั้นจะไม่มีความหมาย
นิยามกรด-เบสของ Lewis นั้นครอบคลุมไปยังไอออนบวกของโลหะ โดยเฉพาะโลหะทรานซิชัน เช่น Fe3+ Cr6+ V5+ Al3+ W6+ Mo6+ ว่าเป็นกรด Lewis ด้วย เพราะมันมีประจุบวกที่แรง สามารถดึงคู่อิเล็กตรอนของโมเลกุลอื่นให้มาเกาะกับมันได้ และยังครอบคลุมถึงสารที่เป็นแก๊ส (มันไม่มีการแตกตัวเป็นไอออนในแก๊สที่อุณหภูมิห้อง) ว่าเป็นกรดหรือเบสก็ได้
เช่น NH3 หรือสารตระกูลเอมีน N(R1R2R3) (เมื่อ R1 R2 และ R3 เป็น H หรือหมู่ aklyl หรือหมู่ alkanol -ROH ที่อาจเหมือนกันหรือแตกต่างกันก็ได้) ว่าเป็นเบสตามนิยามของ Lewis เพราะที่อะตอม N มันมีคู่อิเล็กตรอนจ่ายให้กับอะตอมที่มีความเป็นบวกได้
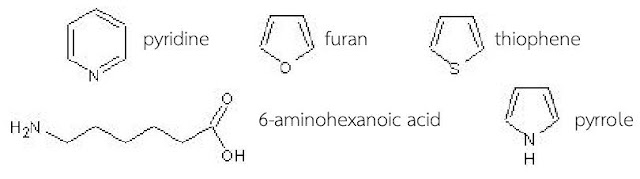
สารประกอบอินทรีย์ Heterocyclic ที่มีอะตอม N S และ O (เช่น pyridine furan และ thiophene ในรูปข้างล่าง) ในวงแหวนก็จัดเป็นเบส Lewis ได้ เพราะอะตอมเหล่านี้มีอิเล็กตรอนคู่โดดเดี่ยวที่อะตอม N S และ O ที่สามารถเอาไปแชร์กับประจุบวกของสารอื่นได้
โมเลกุลบางชนิดเช่น 6-aminohexanoic acid H2N-(C2H2)5-COOH ชื่อมันเป็นกรด (ตามข้อตกลงการเรียกชื่อ) แต่โมเลกุลมันเป็นทั้งกรดและเบสในโมเลกุลเดียวกัน คือหมู่ -COOH มันเป็นกรด Brönsted และหมู่ H2N มันเป็นเบส Lewis ดังนั้นสารตัวนี้จึงทำปฏิกิริยาได้ทั้งในรูปแบบที่เป็นกรดและเบส
ในกรณีของของแข็งที่นำมาใช้งานเป็นตัวเร่งปฏิกิริยาหรือตัวดูดซับนั้น ปรกติเราสนใจเฉพาะความเป็นกรด (หรือเบส) ที่อยู่บนพื้นผิวเท่านั้น เพราะเป็นส่วนที่อีกโมเลกุลหนึ่ง (สารที่จะเข้ามาเกาะบนพื้นผิว) เข้าถึงได้
ตัวอย่างเช่นเรามี NaOH 1 กิโลกรัม ถ้าเราเอาไปใช้ในการสะเทินกรดที่ละลายอยู่ในน้ำ เราจะใช้ความเป็นเบสของ NaOH ได้ทั้งหมด เพราะมันจะละลายน้ำและแตกตัวออก ทำให้ทุก ๆ ไอออนของ OH- เข้าทำปฏิกิริยากับกรดได้
แต่ถ้าเราเอา NaOH 1 กิโลกรัมมาใช้ในการดูดซับแก๊สที่เป็นกรด เราจะใช้ได้เฉพาะส่วนที่อยู่บนพื้นผิวเท่านั้น เพราะแก๊สไม่สามารถซึมลึกเข้าไปในระหว่างไอออน Na+ และ OH- ที่อยู่ในโครงร่างผลึกได้ ดังนั้นปริมาณ NaOH ที่สามารถใช้ในการดูดซับแก๊สกรดได้นั้นจะน้อยกว่ากรณีที่เราเอาไปทำเป็นสารละลาย
ด้วยเหตุนี้ในการใช้งานในรูปแบบดูดซับแก๊สนี้ เราจะสนแต่เฉพาะปริมาณกรดหรือเบส "ที่อยู่บนพื้นผิว" เท่านั้น ดังนั้นในตัวอย่างนี้เราต้องหาวิธีการวัดปริมาณเบสที่วัดเฉพาะ NaOH บนพื้นผิวผลึก NaOH เท่านั้น และวิธีการที่เหมาะสมที่สุดที่ใช้กันในปัจจุบันคือการใช้การดูดซับแก๊ส
ถ้าเราต้องการวัดความเป็นกรดบนพื้นผิวของแข็ง เราก็ต้องหาแก๊สที่เป็นเบสมาให้ของแข็งนั้นดูดซับ และดูว่ามันดูดซับแก๊สที่เป็นเบสไว้ได้มากน้อยเท่าไร
ในทำนองเดียวกันถ้าเราต้องการวัดความเป็นเบสบนพื้นผิวของแข็ง เราก็ต้องหาแก๊สที่เป็นกรดมาให้ของแข็งนั้นดูดซับ และดูว่ามันดูดซับแก๊สที่เป็นกรดได้มากน้อยเท่าใด
หลักการเลือกชนิดแก๊สก็คือ
(ก) มันควรมีความเป็นกรดหรือเบสที่แรงพอที่จะจับกับพื้นผิวของแข็งได้ (นึกภาพว่าเราสามารถไทเทรตหาปริมาณเบสอ่อนด้วยสารละลายกรดแก่ได้ แต่เราไม่สามารถไทเทรตหาปริมาณเบสอ่อนด้วยสารละลายกรดอ่อนได้)
(ข) มันไม่ควรจะเกิดปฏิกิริยาเคมีกลายเป็นสารอื่นบนพื้นผิว (ต้องการแค่ให้มันเกาะเอาไว้เท่านั้น ไม่ให้เกิดปฏิกิริยาสลายตัวหรือทำปฏิกิริยากันเองจนกลายเป็นสารอื่น) และ
(ค) มันควรมีขนาดโมเลกุลที่เหมาะสมด้วย เช่นถ้าเราต้องการวัดจำนวนตำแหน่งที่เป็นกรดและเบสทั้งหมด เราก็ควรเลือกแก๊สที่มีโมเลกุลขนาดเล็กที่สามารถแพร่เข้าไปในรูพรุนได้ แต่ถ้าถ้าต้องการวัดเฉพาะส่วนที่สารตั้งต้นสามารถเข้าทำปฏิกิริยาได้นั้น เราก็ควรเลือกแก๊สที่มีขนาดโมเลกุลใกล้เคียงกับสารตั้งต้น
ถ้าต้องการวัดความเป็นกรด NH3 จัดว่าเป็นแก๊สที่เป็นเบสที่มีขนาดโมเลกุลเล็กสุด ทำให้มันสามารถแพร่เข้ารูพรุนต่าง ๆ ที่มีขนาดเล็กได้ง่าย มีความเป็นเบสที่แรงพอ และเป็นแก๊สที่อุณหภูมิห้อง (แต่บ่อยครั้งที่กลุ่มเราใช้ pyridine แทน NH3 โดยเฉพาะเมื่อต้องการวัดปริมาณความเป็นกรดทั้งหมดบนพื้นผิวและใช้ FID (Flame ionisation detector) ตรวจวัด)
ในทำนองเดียวกันถ้าต้องการวัดความเป็นเบส CO2 ก็จัดว่าเป็นแก๊สที่เป็นกรด (ตรงตำแหน่งอะตอม C มันเป็นประจุ + เนื่องจากอะตอม O 2 อะตอมดึงอิเล็กตรอนออกจากมัน ดังนั้นมันจึงเป็นเสมือนตำแหน่งกรด Lewis ได้) ที่มีขนาดโมเลกุลเล็กสุดที่แพร่เข้ารูพรุนต่าง ๆ ได้ และเป็นแก๊สที่อุณหภูมิห้อง เสียอย่างคือมันเป็นกรดที่ไม่แรงเท่าใดนัก และถ้าเจอกับเบสที่แรงมาก มันจะกลายเป็นสารประกอบ carbonate ที่ทนอุณหภูมิสูงได้ (อุณหภูมิสูงในที่นี้คืออุณหภูมิที่สูงเกินกว่าที่เครื่องวิเคราะห์ TPD จะทำได้ ทำให้เราไม่สามารถวัดปริมาณ CO2 ที่ถูกดูดซับและกลายเป็น CO32- ได้)
ทางกลุ่มของเราเองเคยศึกษาเรื่องการวัดความเป็นกรดโดยใช้ pyrrole เพื่อแยกระหว่างตำแหน่งเบส Brönsted กับเบส Lewis และใช้เทคนิคทางอินฟราเรดตรวจวัด ("Study of basicity characterzation on the surface of catalysts using probe molecule adsorption" โดยจีราพร จันทรศร วิทยานิพนธ์หลักสูตรปริญญามหาบัณฑิตสาขาวิศวกรรมเคมี คณะวิศวกรรมศาสตร์ จุฬาลงกรณ์มหาวิทยาลัย ปีการศึกษา ๒๕๔๓)
การวัดปริมาณ-ความแรงของตำแหน่งที่เป็นกรดบนพื้นผิว MO Memoir : Wednesday 20 January 2553
NH3-TPD - การไล่น้ำและการวาดกราฟข้อมูล MO Memoir : Sunday 27 February 2554
NH3-TPD - การลาก base line MO Memoir : Monday 7 March 2554
Carbocation - การเกิดและเสถียรภาพ MO Memoir : Monday 22 October 2555
ความเข้มข้นของแก๊สที่ใช้ในการดูดซับ MO Memoir : Sunday 18 November 2555
ถัดจากตอบคำถามดังกล่าวไปแล้วก็มีอีเมล์ถามคำถามเพิ่มเติมดังนี้
เสาร์ที่ ๑๗ กุมภาพันธ์ พ.ศ. ๒๕๕๖
ขอขอบคุณมากครับ ผมจะนำความรู้ที่ได้ทำให้เกิดประโยชน์ครับ
ใช่ครับอาจารย์ xxx เป็นอาจารย์ที่ปรึกษาโครงงานของผมครับ ตอนนี้ผมทำโครงงานเกี่ยวกับตัวเร่งปฏิกิริยาของแข็ง ครับ ใช้ผลิตไบโอดีเซลครับ ตัวรองรับทำจาก xxx ครับ
ซึ่งในส่วนที่ได้ถามไปนั้นอยู่ในวรรณกรรมครับ คือสงสัยว่าทำไมเค้าถึงเลือกใช้แก๊สนี้ ซึ่งตอนนี้ผมเข้าใจแล้วครับ
เหลืออีกหนึ่งอย่างครับที่ผมไม่เขาใจครับเกี่ยวกับโครงสร้างผลึก จากการตรวจสอบผลึกของสาร Ba/ZrO2 เค้าพบว่าเป็นโครงสร้างแบบ rhombohedral (Rh-) hexagonal ซึ่งเกิดจากการเติม Ba(NO3)2 ลงบน ZrO2 แล้วเผาที่ 650 องศาเซลเซียส พบว่า Ba(NO3)2 กลายเป็น BaO แล้วตัวรองรับ ZrO2 ที่มีโครงสร้างเดิมคือโมโนคลินิกจะกลายเป็น Hexagonal ซึ่งที่ผมเข้าใจอยู่คือมีโครงสร้างสองชนิดคือ rhombohedral ของ BaO เกาะอยู่กับ Hexagonal ของ ZrO2 ใช่หรือไม่ครับ
ขอขอบพระคุณเป็นอย่างสูงครับ
เกลือไนเทรต (NO3-) เป็นเกลือที่ไม่เสถียร เมื่อเผาที่อุณหภูมิสูงพอ หมู่ไนเทรตจะสลายตัวกลายเป็นออกไซด์
แต่ตอนที่เราเตรียมเราใช้เกลือไนเทรตนั้นก็เพราะมันละลายน้ำได้ดี (อีกพวกคือเกลือสารอินทรีย์ เช่น acetate oxalate เป็นต้น หรือถ้ามีปัญหาก็อาจต้องใช้การปรับ pH ช่วย โดยเลือกช่วง pH ที่ละลายเกลือแต่ไม่ละลาย support)
อย่างเช่นถ้าต้องการให้มี BaO บน ZrO2 เราไม่สามารถใส่ BaO ลงไปบน ZrO2 ได้โดยตรง เราจึงใช้วิธีเอาเกลือไนเทรตมาละลายน้ำ และให้ ZrO2 ดูดซับสารละลายนั้นเอาไว้ จากนั้นก็ระเหยน้ำออก เราก็จะมีเกลือ Ba(NO3)2 เกาะอยู่บนพื้นผิว ZrO2 ซึ่งพอเราเอามันไปเผา เกลือ Ba(NO3)2 ก็จะสลายตัว เราก็จะได้ BaO เกาะอยู่บน ZrO2
ถ้าออกไซด์สองชนิดไม่ทำปฏิกิริยากัน ออกไซด์แต่ละตัวก็จะมีโครงสร้างที่เป็นของมันเอง
แต่ถ้ามีพีคแปลกประหลาดเกิดขึ้นที่ไม่ใช่ของทั้ง BaO และ ZrO2 ก็เป็นไปได้ว่ามีการเกิดโครงสร้างใหม่เกิดขึ้น
ออกไซด์หลายตัวนั้นมีโครงสร้างผลึกที่แตกต่างกันออกไปได้ ขึ้นอยู่กับอุณหภูมิ บางโครงสร้างนั้นไม่เสถียรที่อุณหภูมิสูง แต่บางโครงสร้างนั้นเสถียรทุกช่วงอุณหภูมิ
อย่างเช่นในกรณีของคุณนั้นโครงสร้างเริ่มแรกนั้นอาจเป็นโครงสร้างที่คงอยู่ได้ตราบเท่าที่มันยังไม่เคยเจออุณหภูมิสูง แต่พอมันเจออุณหภูมิสูง ไอออนมันจะมีการจัดเรียงตัวใหม่เป็นโครงสร้างที่มีเสถียรภาพมากกว่า และเมื่อมันเย็นตัวลงมันก็จะไม่เปลี่ยนกลับคืนเดิม
เช่น TiO2 ในเฟส anatase นั้นมีพื้นที่ผิวสูง แต่ถ้าได้รับความร้อนเกิน 550ºC มันจะเปลี่ยนโครงสร้าง (ไอออน Ti4+ และ O2- มีการจัดเรียงตัวกันใหม่) กลายเป็นเฟส rutile ที่มีพื้นที่ผิวต่ำกว่า (สูตรยังเป็น TiO2 เหมือนเดิม)
และหลังจากที่มันเปลี่ยนเฟสจาก anatase ไปเป็น rutile แล้ว แม้ว่าเราจะทำให้มันเย็นลงจนมีอุณหภูมิต่ำกว่า 550ºC มันก็จะไม่เปลี่ยนกลับมาเป็นเฟส anatase เหมือนเดิม (เปลี่ยนแล้วเปลี่ยนเลย)
นั่นคือคำถาม-คำตอบ ที่มีการโต้ตอบกันเมื่อสุดสัปดาห์ที่ผ่านมา
วันพุธที่ 20 มกราคม พ.ศ. 2553
การวัดปริมาณ-ความแรงของตำแหน่งที่เป็นกรดบนพื้นผิว MO Memoir : Wednesday 20 January 2553
เนื่องจากได้มอบหมายให้สมาชิกของกลุ่มผู้หนึ่ง (สาวน้อยใส่แว่นจากจังหวัดติดประเทศกัมพูชา) ทำการวัดปริมาณของตำแหน่งที่เป็นกรดบนพื้นผิวตัวเร่งปฏิกิริยา โดยใช้เทคนิคการดูดซับไพริดีน และใช้เครื่อง GC ทำการวิเคราะห์ Memoir ฉบับนี้จึงขอทบทวนเรื่องการวัดความเป็นกรดของพื้นผิว โดยจะเน้นไปที่การประยุกต์ใช้เครื่อง GC ในการวิเคราะห์ดังกล่าว
วิธีการหลักในปัจจุบันที่นิยมใช้ในการวัดปริมาณ (amount) และความแรง (strength) ของตำแหน่งที่เป็นกรดบนพื้นผิวตัวเร่งปฏิกิริยาคือ การให้พื้นผิวดูดซับโมเลกุลแก๊สที่เป็นเบส แล้วประเมินปริมาณและความแรงของตำแหน่งที่เป็นกรดจากจำนวนโมเลกุลแก๊สที่เป็นเบสที่พื้นผิวดูดซับเอาไว้ได้ที่อุณหภูมิต่าง ๆ กัน
โมเลกุลแก๊สที่เป็นเบสที่นิยมนำมาใช้คือแอมโมเนีย (ammonia - NH3) และไพริดีน (pyridine - C5NH6) ซึ่งต่างก็มีจุดเด่น-จุดด้อยที่แตกต่างกัน
ในภาวะที่เป็นของเหลวนั้น แอมโมเนียมีฤทธิ์เป็นเบสที่แรงกว่าไพริดีน แต่ในภาวะที่เป็นแก๊สนั้น ไพริดีนมีฤทธิ์เป็นเบสแรงกว่าแอมโมเนีย
ดังนั้นไพริดีนจึงสามารถจับกับตำแหน่งที่เป็นกรดที่มีความแรงต่ำได้ดีกว่าแอมโมเนีย (ซึ่งแอมโมเนียอาจไม่จับกับตำแหน่งที่เป็นกรดที่มีความแรงต่ำ) แต่การที่แอมโมเนียมีขนาดโมเลกุลเล็กกว่าและมีน้ำหนักโมเลกุลต่ำกว่า จึงทำให้แอมโมเนียสามารถซอกซอนเข้าไปในรูพรุนขนาดเล็กได้ดีกว่าไพริดีน
แต่สำหรับเครื่องมือวิเคราะห์ต่าง ๆ นั้น (พวกอุปกรณ์ Temperature programmed ต่าง ๆ ที่ขายเป็นอุปกรณ์สำเร็จรูป) มักจะนิยมใช้แอมโมเนียเป็นโมเลกุลที่จะถูกดูดซับบนพื้นผิว ทั้งนี้เป็นเพราะแอมโมเนียเป็นแก๊สที่อุณหภูมิห้อง จึงไม่ต้องเป็นห่วงว่าจะเกิดการควบแน่นในระบบท่อต่าง ๆ ของเครื่องมือ ในขณะที่ไพริดีนนั้นมีจุดเดือดอยู่ที่ 115.2 องศาเซลเซียส
แต่สำหรับบางงานที่ต้องทำการดัดแปลงอุปกรณ์ที่ออกแบบมาเพื่อทำงานอื่น เพื่อใช้วัดปริมาณการดูดซับ/คายซับ (adsorption/desorption) แก๊สเหล่านี้ การใช้ไพริดีนนั้นอาจเหมาะสมมากกว่า
ตัวอย่างหนึ่งของงานดังกล่าวคือการประยุกต์ใช้เครื่องแก๊สโครมาโทกราฟเพื่อวัดการดูดซับ/คายซับ
เมื่อมาถึงจุดนี้อาจมีคนสงสัยว่า ทำไมในเมื่อแลปของเรามีเครื่องวิเคราะห์ดังกล่าวอยู่แล้ว (ที่เรียกกันเป็นการภายในว่าเครื่อง TPX) ซึ่งวัดโดยใช้แอมโมเนีย แต่ยังต้องมาทำการประยุกต์ใช้เครื่องแก๊สโครมาโทกราฟเพื่อวัดการดูดซับไพริดีน
คำตอบคือเครื่อง TPX ที่ใช้ในแลปนั้นวิเคราะห์ผลจากการคายซับโดยใช้ detector ชนิด TCD (Thermal Conductivity Detector) แบบเดียวกับที่ใช้กับเครื่อง GC ทั่วไป ซึ่ง detector แบบนี้มีปัญหา base line เคลื่อนตำแหน่งในระหว่างการทำ temperature programme ซึ่งเป็นเรื่องปรกติของมัน และมันยังไม่แยกแยะด้วยว่าพีคที่เห็นนั้นเกิดจาก
- ความแตกต่างระหว่างอุณหภูมิของคอลัมน์ที่ใช้วัดกับ reference column
- แอมโมเนียที่คายซับออกมาจากพื้นผิว หรือ
- น้ำในโครงร่างผลึกที่ตัวเร่งปฏิกิริยาคายออกมา หรือ
- ออกซิเจนที่ตัวเร่งปฏิกิริยาคายออกมา (ในกรณีของโลหะออกไซด์บางชนิดที่จะถูกรีดิวซ์ที่อุณหภูมิสูง)
ดังนั้นในการอ่านผล NH3-TPD ถ้าไม่คำนึงถึงปัจจัยต่าง ๆ เหล่านี้แล้วจึงมักลงเอยที่ผลการทดลองที่ทำซ้ำไม่ได้ (ถ้ากล้าลองทำดูนะ) หรือการประเมินค่าปริมาณ-ความแรงของตำแหน่งที่เป็นกรดผิดไปหลายเท่าตัว (เคยเล่าไว้ครั้งหนึ่งแล้วใน Memoir ฉบับ Friday 30 January 2552 เรื่อง Thermal Conductivity Detector)
ก่อนอื่นเราลองมาดูกันก่อนว่า การวัดปริมาณ-ความแรงของตำแหน่งที่เป็นกรดด้วยการคายซับ (desorption) และการดูดซับ (adsorption) นั้นแตกต่างกันอย่างไร
การวัดด้วยเทคนิคการคายซับ (เช่นพวก Temperature Programmed Desorption - TPD) นั้นดูจะเป็นที่นิยมกันมากกว่า ทั้งนี้เป็นเพราะเทคนิคดังกล่าวสามารถให้ข้อมูลทั้งปริมาณและความแรงได้ด้วยการทดลองเพียงครั้งเดียว ในเทคนิคดังกล่าวนั้น เราจะให้พื้นผิวดูดซับแก๊สที่เป็นเบส (ที่ใช้กันเป็นปรกติคือแอมโมเนีย) ไว้จนอิ่มตัวก่อน โดยให้เหลือเฉพาะแอมโมเนียที่เกิด chemisorption บนพื้นผิว (ซึ่งทำได้ไม่ยาก เพราะอุณหภูมิห้องที่ใช้ในการดูดซับก็สูงกว่าจุดเดือดของแอมโมเนียอยู่แล้ว) จากนั้นจึงค่อย ๆ เพิ่มอุณหภูมิตัวอย่างเพื่อให้พื้นผิวคายแก๊สแอมโมเนียออกมา ขนาดของพีค (หรือพื้นที่ใต้พีค) ที่ได้เป็นตัวบอกปริมาณแอมโมเนียที่คายออกมา ถ้าพีคมีขนาดใหญ่ก็แสดงว่าพื้นผิวจับแอมโมเนียได้มาก มีตำแหน่งที่เป็นกรดอยู่เป็นจำนวนมาก ส่วนอุณหภูมิที่พื้นผิวคายแอมโมเนียออกมาเป็นตัวบอกความแรงของตำแหน่งที่เป็นกรด ถ้าใช้อุณหภูมิสูงจึงจะไล่แอมโมเนียได้ก็แสดงว่ากรดบนพื้นผิวมีความแรงสูง)
แต่การอ่านผลพีคที่ได้จากการคายซับแอมโมเนียนั้นต้องระมัดระวังให้มาก เพราะสิ่งที่เห็นเป็นพีคนั้นอาจไม่ได้เกิดจากแอมโมเนียที่หลุดออกมาจากพื้นผิวก็ได้ โดยเฉพาะอย่างยิ่งพีคที่เห็นเกิดขึ้นที่อุณหภูมิสูง (ดังสาเหตุที่กล่าวไว้ในหน้าที่แล้ว) ดังนั้นเพื่อทำการแยกแยะว่าพีคที่เห็นนั้นเป็นพีคการคายซับแอมโมเนียหรือไม่ จึงควรทำการทดสอบด้วยการดูดซับแอมโมเนีย การทดสอบดังกล่าวทำให้โดยการบรรจุตัวอย่างเข้าไปในท่อ และนำไปติดแทนคอลัมน์ของเครื่องแก๊สโครมาโทกราฟ
ตัวอย่างเช่นสมมุติว่าเราการทดลองวัด NH3-TPD และพบพีคที่อุณหภูมิ 150, 250 และ 350 องศาเซลเซียส และสงสัยว่าพีคที่ 350 องศาเซลเซียสเป็นพีคเกิดจากการคายซับแอมโมเนียหรือไม่ การทดสอบทำได้โดย
- บรรจุตัวอย่างในปริมาณหนึ่ง (เช่น 1 กรัม) เข้าไปในคอลัมน์เปล่า
- นำคอลัมน์ดังกล่าวไปติดตั้งแทนคอลัมน์ของเครื่อง GC
- ตั้งอุณหภูมิ oven ไว้สักประมาณ 300 องศาเซลเซียส (ให้ต่ำกว่าอุณหภูมิปรากฎของพีค NH3-TPD ที่ต้องการทดสอบเล็กน้อย)
- ทำการฉีดแก๊สแอมโมเนียเข้าไป
- ถ้าพบว่าแอมโมเนียที่ฉีดเข้าไปนั้นหายไปบางส่วน (คือถูกตัวอย่างดูดซับเอาไว้) ก็แสดงว่าพีคที่เห็นที่ 350 องศาเซลเซียสนั้นเป็นไปได้ที่จะเป็นพีคที่เกิดจากการคายซับแอมโมเนีย
- แต่ถ้าพบว่าแอมโมเนียที่ออกมาเท่ากับ (หรือเกือบเท่ากับ) แอมโมเนียที่ฉีดเข้าไป แสดงว่าพีคที่เห็นปรากฏที่ 350 องศาเซลเซียสนั้นไม่ได้เกิดจากการคายซับแอมโมเนีย
ด้วยการทำซ้ำเดิมแต่ลดอุณหภูมิลง เช่นเหลือ 200 องศาเซลเซียส ก็จะทำให้ทราบได้ว่าพีคที่เห็นที่ 250 องศาเซลเซียสนั้นเกิดจากการคายซับแอมโมเนียด้วยหรือไม่
(การหาปริมาณแอมโมเนียที่ฉีดเข้าไปนั้นทำได้โดยการฉีดผ่านคอลัมน์เปล่าที่ไม่มีการบรรจุตัวอย่าง หรือฉีดผ่านคอลัมน์ที่บรรจุสารตัวอย่างไปจนกระทั่งปริมาณที่ออกมาคงที่ นั้นแสดงว่าตัวอย่างไม่ดูดซับแอมโมเนียแล้ว)
หรือเราอาจทำการทดสอบโดยวัดการดูดซับแอมโมเนียที่อุณหภูมิต่ำเลย (เช่น 50 องศาเซลเซียส) โดยทำการฉีดแอมโมเนียให้ไหลผ่านตัวอย่างแล้ววัดปริมาณแอมโมเนียที่หลุดรอดออกมา ซึ่งในเข็มแรก ๆ ที่ฉีดเข้าไปนั้นจะเห็นว่ามีแอมโมเนียหายไปมาก ส่วนในเข็มถัดไปจะเห็นว่าปริมาณแอมโมเนียที่หายไปนั้นจะลดลง ทำการฉีดต่อไปเรื่อย ๆ จนพบว่าปริมาณแอมโมเนียที่ฉีดเข้าไปเท่ากับปริมาณแอมโมเนียที่ออกมา (ปริมาณที่วัดได้ในเข็มหลัง ๆ นั้นเท่ากันหมด) นั่นแสดงว่าตัวอย่างดูดซับแอมโมเนียไว้จนอิ่มตัวแล้ว จากนั้นจึงคำนวณปริมาณแอมโมเนียที่ตัวอย่างดูดซับไว้ได้จากการรวมปริมาณแอมโมเนียที่หายไปในการฉีดแต่ละครั้งก็จะได้ปริมาณแอมโมเนียที่ตัวอย่างดูดซับไว้จนอิ่มตัว (ดูตัวอย่างข้างล่างประกอบ) จากนั้นนำปริมาณแอมโมเนียที่ตัวอย่างสามารถดูดซับไว้จนอิ่มตัวไปเทียบกับปริมาณแอมโมเนียที่คำนวณได้จากพีค NH3-TPD ถ้าพบว่าต้องใช้พีคที่ 150, 250 และ 350 องศาเซลเซียสรวมกันทั้ง 3 พีคจึงจะได้ปริมาณแอมโมเนียที่คายออกมาเท่ากับปริมาณที่วัดได้จากการดูดซับก็แสดงว่าทั้ง 3 พีคนั้นเกิดจากการคายซับแอมโมเนีย แต่ถ้าพบว่าใช้พื้นที่ของพีคที่ 150 และ 250 องศาเซลเซียสก็จะได้ปริมาณแอมโมเนียที่คายออกมาเท่ากับปริมาณที่วัดได้จากการดูดซับก็แสดงว่าเฉพาะพีค 150 และ 250 องศาเซลเซียสเท่านั้นที่เกิดจากการคายซับแอมโมเนีย ส่วนพีคปรากฏที่ 350 องศาเซลเซียสเกิดจากสาเหตุอื่น
ตัวอย่าง การคำนวณปริมาณแอมโมเนียที่ถูกดูดซับ
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านคอลัมน์เปล่า 100000
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านตัวอย่างครั้งที่ 1 10000
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านตัวอย่างครั้งที่ 2 30000
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านตัวอย่างครั้งที่ 3 60000
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านตัวอย่างครั้งที่ 4 90000
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านตัวอย่างครั้งที่ 5 100000
พื้นที่ใต้พีคเมื่อฉีดแอมโมเนียผ่านตัวอย่างครั้งที่ 6 100000
จะเห็นว่าการฉีดในครั้งที่ 1-4มีแอมโมเนียออกมาน้อยกว่าที่ฉีดเข้าไป (การฉีดผ่านคอลัมน์เปล่า) ดังนั้นจะหาปริมาณแอมโมเนียที่ตัวอย่างดูดซับเอาไว้ได้จากการรวมพื้นที่ใต้พีคที่หายไปของการฉีดครั้งที่ 1-4 ดังนี้
ผลรวมพื้นที่ใต้พีคที่หายไป = (100000-10000) + (100000-30000) + (100000-60000) + (100000 - 90000) = 210000
จากนั้นจึงนำผลรวมของพื้นที่ใต้พีคที่หายไปนี้ไปคำนวณเป็นปริมาณแอมโมเนียที่ถูกตัวอย่างดูดซับเอาไว้ และเปรียบเทียบกับปริมาณแอมโมเนียที่คายซับออกมาเมื่อวัดด้วยเทคนิค NH3-TPD ก็จะทำให้สามารถระบุได้ว่าพีคของกราฟ NH3-TPD ที่เห็นนั้นเกิดจากการคายซับแอมโมเนียทุกพีคหรือไม่
ผมเล่ามาซะยาวเรื่องการฉีดแอมโมเนีย ทั้ง ๆ ที่ในทางปฏิบัตินั้นผมจะนิยมใช้การฉีดไพริดีนมากกว่า ทั้งนี้เป็นเพราะ
- ไพริดีนเป็นของเหลว ไม่มีปัญหาเรื่องการปรับแก้ความดันภายในเข็มที่จะทำการฉีด
- เราตรวจวัดไพริดีนได้ด้วย FID ซึ่งมีความไวสูงกว่า TCD และยังมี linearity ดีกว่าด้วย
- หลังจากฉีดไพริดีนจนตัวอย่างดูดซับจนอิ่มตัวแล้ว อาจยังสามารถทำการวัดตรวจสอบโดยการเพิ่มอุณหภูมิ oven เพื่อให้ไพริดีนหลุดออกมาจากตัวอย่าง แล้ววัดปริมาณไพริดีนที่ตัวอย่างคายออกมา เพื่อดูว่าปริมาณที่ดูดซับไว้นั้นเท่ากับปริมาณที่คายออกมาหรือไม่ ถ้าเท่ากันก็แสดงว่าการวิเคราะห์ไม่มีปัญหา แต่การทำเช่นนี้มีขีดจำกัดตรงที่เครื่อง GC ที่เราใช้นั้นเพิ่มอุณหภูมิได้ไม่เกิน 400 องศาเซลเซียส (แค่ 350 ก็เต็มกลืนแล้ว)
การวัดด้วยการฉีดไพริดีนทำเหมือนกับการวัดด้วยการฉีดแอมโมเนียที่กล่าวมาข้างต้น เพียงแต่ว่าจะใช้อุณหภูมิที่สูงกว่าในการวัด เพราะไพริดีนมีจุดเดือดสูงกว่า เท่าที่จำได้ดูเหมือนจะใช้อุณหภูมิ oven ประมาณ 150 องศาเซลเซียส ทั้งนี้เพื่อให้มั่นใจว่าอุณหภูมิของตัวอย่างที่บรรจุอยู่ในคอลัมน์นั้นจะสูงเกินกว่าจุดเดือดของไพริดีน (115.2 องศาเซลเซียส) สิ่งที่พึงระลึกไว้ในการตั้งอุณหภูมิคือ ถ้าใช้อุณหภูมิที่สูงเกินไปก็จะทำให้มองไม่เห็นตำแหน่งที่เป็นกรดอ่อนบนพื้นผิวได้
การที่ต้องตั้งให้อุณหภูมิ oven สูงกว่าอุณหภูมิจุดเดือดของไพริดีนค่อนข้างมากเป็นเพราะคอลัมน์ที่บรรจุตัวอย่างนั้นมีตัวอย่างเพียงปริมาณเล็กน้อย แก๊สพาหะ (ไนโตรเจน) ที่เย็นที่ไหลเข้ามาในคอลัมน์จะไหลผ่านคอลัมน์และตัวอย่างไปได้อย่างรวดเร็วโดยที่อุณหภูมิยังไม่เพิ่มสูงจนถึงจุดเดือดของไพริดีน ดังนั้นวิธีการแก้ปัญหาวิธีการหนึ่งคือการลดความเร็วในการไหลของแก๊สพาหะ และ/หรือเพิ่มระยะทางการไหลของแก๊สพาหะในช่วงจากตำแหน่งฉีดจนถึงตำแหน่งบรรจุตัวอย่างให้ยาวมากขึ้น พึงระลึกไว้ด้วยว่าการลดความเร็วในการไหลของแก๊สพาหะจะส่งผลต่อความกว้างของพีค ถ้าลดความเร็วต่ำเกินไปก็จะทำให้พีคกว้างและลากหางมากขึ้น
ก่อนทำการทดลองนั้นควรทำการคำนวณก่อนโดยใช้ข้อมูลจากพีค NH3-TPD โดย
(ก) สมมุติว่าพีคที่ปรากฏทั้งหมดนั้นเป็นพีคการคายซับแอมโมเนีย
(ข) แปลงพื้นที่ใต้พีคดังกล่าวเป็นจำนวนโมลแอมโมเนีย
(ค) ให้จำนวนโมลแอมโมเนียที่คำนวณได้จาก (ข) เท่ากับจำนวนโมลไพริดีน (มากที่สุดที่เป็นไปได้) ที่พื้นผิวสามารถดูดซับไว้ได้
(ง) แปลงจำนวนโมลไพริดีนที่ได้มาจาก (ค) เป็นปริมาตรสูงสุด (ไมโครลิตร) ของไพริดีนที่ตัวอย่างสามารถดูดซับไว้ได้
(จ) ใช้ปริมาตรที่ได้จาก (ง) เป็นตัวกำหนดว่าในการฉีดไพริดีนแต่ละครั้ง ควรฉีดเข้าไปสักเท่าใด
กล่าวคือสมมุติว่าเราได้ปริมาตรจากข้อ (ง) เท่ากับ 1 ไมโครลิตร ดังนั้นในการฉีดแต่ละครั้งนั้นเราอาจฉีดไพริดีนเพียง 0.5 ไมโครลิตร ซึ่งในการฉีดครั้งแรกจะเห็นไพริดีนหายไปมาก (ถูกตัวอย่างดูดซับเอาไว้) แต่การฉีดครั้งหลัง ๆ จะเห็นออกมามากขึ้นเรื่อย ๆ จนคงที่
เหตุผลที่ไม่ให้ฉีดครั้งแรกในปริมาตร 1 ไมโครลิตรหรือมากกว่านั้นก็เพื่อให้เห็นการดูดซับจนอิ่มตัวได้ง่าย
ตอนนี้ก็ได้อธิบายและชี้แจงเหตุผลของวิธีการวัดไปเรียบร้อยแล้ว คงเหลือแต่ลงมือทำเท่านั้น และหวังว่าสาวน้อย 150 เซนติเมตร (คิดว่าความจริงคงเกินค่านี้เล็กน้อย แต่ขอปัดตัวเลขให้มันกลม ๆ ก็แล้วกัน) จากเมืองคนดุ จะหาโอกาสมาดูด้วย เพราะต้องเป็นผู้สืบทอดงานดังกล่าวต่อไป
วันเสาร์ที่ 22 สิงหาคม พ.ศ. 2552
สรุปคำถาม-ตอบการสอบวันศุกร์ที่ ๓ เมษายน ๒๕๕๒ MO Memoir : วันเสาร์ที่ ๔ เมษายน ๒๕๕๒
ในการสอบเมื่อเย็นวันศุกร์ที่ 3 เมษายนที่ผ่านมานั้น ผมขอสรุปคำถามที่กรรมการได้ซักถาม และคำตอบที่ถูกต้องที่ควรจะต้องตอบ เพื่อที่จะได้ไม่มีปัญหาในการสอบครั้งต่อไป ผมนึกคำถามไหนออกได้ก่อนก็พิมพ์ลงไปเลย
1. การแบ่งความแรงของตำแหน่งที่เป็นกรดว่าอันไหนเป็นอ่อนหรือแก่ ใช้เกณฑ์ใด มีมาตรฐานกำหนดหรือไม่
ปัญหานี้มักจะเกิดกับผู้ที่ชินกับภาพของกรดบรอนสเตดที่เป็นสารละลายในน้ำ ในกรณีของกรดบรอนสเตดที่เป็นสารละลายในน้ำนั้น ถ้ากรดสามารถแตกตัวได้ 100% ก็จัดว่าเป็นกรดแก่ เช่น HCl HNO3 H2SO4 จัดว่าเป็นกรดแก่ แต่ใครมีความแรง (strength) มากกว่ากันนั้นไม่สามารถบอกได้ ถ้ากรดนั้นไม่สามารถแตกตัวได้ 100% ก็จะถือว่าเป็นกรดอ่อน ในกรณีของกรดอ่อนเช่น HCOOH CH3COOH C6H5COOH เราสามารถบอกได้ว่ากรดตัวไหนมีความแรงมากกว่ากัน โดยดูจากความสามารถในการแตกตัว กรดตัวใดสามารถแตกตัวได้ใกล้ 100% มากกว่าก็จัดว่าเป็นกรดที่มีความแรงมากกว่า
หลักเกณฑ์ดังกล่าวไม่สามารถใช้ได้กับความเป็นแบบกรดลิวอิส (ที่ดูความสามารถในการรับคู่อิเล็กตรอน ไม่ใช่ความสามารถในการจ่ายโปรตอน) และใช้ไม่ได้กับตำแหน่งที่เป็นกรดที่อยู่บนพื้นผิวของแข็ง (ซึ่งมีทั้งแบบบรอนสเตด (หมู่ไฮดรอกซิล -OH) และแบบลิวอิส (ไอออนบวกของโลหะ)) เพราะความแรงของตำแหน่งที่เป็นกรดบนพื้นผิวไม่ได้ดูจากความสามารถในการจ่ายโปรตอน แต่ดูจากความยากในการดึงเอาเบสที่ถูกดูดซับเอาไว้บนพื้นผิวออกไป ตำแหน่งกรดที่ต้องใช้อุณหภูมิที่สูงกว่าในการดึงเอาเบสที่ถูกดูดซับไว้ ก็จะเป็นตำแหน่งกรดที่มีความแรงมากกว่าตำแหน่งกรดที่ใช้อุณหภูมิที่ต่ำกว่าในการดึงเอาเบสที่ถูกดูดซับเอาไว้ออกไป ดังนั้นการเปรียบเทียบก็จะเป็นแบบตัวนี้มีความเป็นกรดที่แรงมากกว่าตัวนี้ แต่อย่าเอาเรื่องตัวไหนเป็นกรดอ่อนหรือกรดแก่ไปยุ่ง เพราะมันเข้ากันไม่ได้
อุณหภูมิที่ต้องใช้ในการดึงเอาเบสที่ถูกดูดซับเอาไว้ออกมานั้นนอกจากจะขึ้นอยู่กับชนิดพื้นผิวของแข็งแล้ว ยังขึ้นอยู่กับชนิดของเบสที่ใช้ด้วย (วัดด้วยแอมโมเนียและไพริดีนจะให้ค่าอุณหภูมิที่แตกต่างกัน) และถ้าจะให้ดีแล้วถ้าจะเปรียบเทียบกันควรกระทำที่อัตราการเพิ่มอุณหภูมิเดียวกันด้วย
2. การล้างด้วยกรดทำไปเพื่ออะไร และทำไมถึงเลือกใช้กรดไนตริก (HNO3)
ในการตกผลึกนั้นมักจะมีส่วนที่เป็นผลึกไม่สมบูรณ์หรือสารประกอบแปลกปลอมเกิดขึ้น (เช่นอะลูมิเนียมที่เติมเข้าไปอาจเกิดเป็นอะลูมินา Al2O3 หรือโคบอลต์ที่เติมเข้าไปกลายเป็น CoOx แทน) ตัวผลึกไม่สมบูรณ์หรือสารประกอบแปลกปลอมเหล่านี้อาจไปปิดกั้นรูพรุนหรือทำให้เกิดปฏิกิริยาข้างเคียงได้ จึงจำเป็นที่ต้องหาทางกำจัดออกไป
โครงสร้างของซิลิกา (SiO2) เป็นโครงสร้างที่ทนต่อกรด (เหมือนแก้วที่ทนกรดแต่ไม่ทนด่าง สังเกตได้จากเครื่องแก้วที่ใช้กับด่างแรง ๆ มักจะมีผิวที่เป็นฝ้าที่ขัดยังไงก็ไม่ออก เพราะมันไม่ใช่คราบสกปรก แต่เป็นเพราะด่างเข้าไปกัดพื้นผิวให้มันไม่ราบเรียบ) การล้างด้วยกรดจึงทำให้มั่นใจว่าจะไม่ละลายเอาส่วนที่เป็นซิลิกาออกมา แต่ก็สามารถล้างเอาสารประกอบโลหะออกไซด์ส่วนใหญ่ออกมาได้
การที่เลือกล้างด้วยกรดไนตริก (HNO3) นั้นก็เพื่อที่จะมั่นใจได้ว่าจะไม่มีส่วนที่เป็นไอออนลบ (anion) ตกค้างอยู่บนพื้นผิวหลังการชะล้าง ถ้าคุณล้างด้วยกรด HNO3 หลังจากที่คุณล้างเอากรดออกแล้วก็ยังอาจมีหมู่ไนเทรต NO3- ตกค้างอยู่บนพื้นผิว แต่เมื่อคุณนำไปเผาอีกครั้ง หมู่ไนเทรตนี้ก็จะสลายตัวเป็นแก๊สออกไป แต่ถ้าคุณล้างด้วยกรด HCl หรือ H2SO4 หลังจากที่คุณล้างกรดออกแล้วก็ยังอาจมี Cl- หรือ SO42- ตกค้างบนพื้นผิว ซึ่งหมู่เหล่านี้จะไม่ถูกกำจัดออกไปในขั้นตอนการเผา
3. เครื่อง GC แยกสารได้ด้วยหลักการใด
หลักการทำงานของโครมาโทกราฟนั้นจะเหมือนกันหมด คืออาศัยความแตกต่างของการดูดซับบนพื้นผิว ตัวไหนถูกพื้นผิวจับไว้แน่นก็จะเคลื่อนตัวช้ากว่าตัวที่ไม่ถูกจับ ในกรณีของเครื่อง GC นั้นสารที่ทำหน้าที่ดูดซับที่เราเรียกว่า packing จะถูกบรรจุอยู่คอลัมน์ แก๊สตัวไหนถูก packing จับไว้แน่นก็จะออกมาหลังตัวที่ไม่ถูกจับไว้แน่น
ชนิดของ packing และสารที่ต้องการแยกจะต้องสัมพันธ์กัน ในกรณีของสารประกอบที่ไม่มีขั้ว (เช่นพวกไฮโดรคาร์บอน) การแยกสารมักจะเป็นไปตามจุดเดือดของสาร คือตัวที่มีจุดเดือดต่ำจะออกมาก่อนตัวที่มีจุดเดือดสูง
ในกรณีของสารประกอบที่มีขั้ว (เช่น แอลกอฮอล์ กรดอินทรีย์ อัลดีไฮด์ ฟีนอล) จะมีเรื่องความแรงของส่วนที่เป็นขั้วเข้ามาร่วมด้วยนอกเหนือไปจากจุดเดือด กล่าวคือถ้าจุดเดือดใกล้กัน สารตัวที่มีความเป็นขั้วแรงกว่าก็จะออกมาทีหลังตัวที่ความแรงของขั้วน้อยกว่า ถ้าความเป็นขั้วใกล้เคียงกัน (เช่นกรณีของ o-cresol และ p-cresol) ตัวที่มีจุดเดือดสูงกว่าก็มักจะออกมาทีหลังตัวที่มีจุดเดือดต่ำกว่า
ในกรณีของแก๊สถาวร (เช่น O2 N2 CO2 เป็นต้น) อาจแยกด้วยขนาดโมเลกุล โดยจะใช้ packing ที่มีรูพรุนขนาดเล็ก แก๊สโมเลกุลเล็กก็จะแทรกเข้าไปในรูพรุนและถูกดูดซับเอาไว้ได้ ส่วนแก๊สโมเลกุลใหญ่ที่เข้ารูพรุนไม่ได้ก็จะเคลื่อนที่ผ่านออกไป
4. ไอออนของ Al หรือ Co ที่เติมเข้าไปนั้นไปอยู่ที่ไหน
วิธี Rapid crystallization ที่เรานำมาดัดแปลงใช้เตรียม TS-1 นั้นเป็นวิธีที่พัฒนาขึ้นมาเพื่อเตรียม ZSM-5 (หรือ MFI ซึ่งย่อมาจาก Mobil Five) ซึ่งเป็นซีโอไลต์ที่ได้จากการแทนที่ไอออนซิลิกอน (Si4+) ด้วยอะลูมิเนียม (Al3+) ดังนั้นในกรณีของ Al-TS-1 นั้นน่าจะมั่นใจได้ว่ามี Al3+ เข้าไปอยู่ในโครงสร้างได้แน่ ๆ
ส่วนในกรณีของ Co นั้นคงเป็นการยากที่จะบอกได้ สิ่งที่คาดหวังได้ก็คือ Co ที่เหลือรอดจากการล้างด้วยกรดน่าจะเป็น Co ที่อยู่ในโครงสร้าง (ตรงจุดนี้ถ้ามีโอกาสอยากให้ลองเอาเกลือ Cobalt oxide ซักตัวละลายในกรดไนตริกดู ถ้าหากว่ากรดไนตริกสามารถละลายเกลือโคบอลต์ออกไซด์ได้ เราก็จะพูดได้เต็มปากว่าโคบอลต์ที่เหลือหลังการล้างด้วยกรดไม่ได้อยู่ในรูปโคบอลต์ออกไซด์แน่)
5. รู้ได้อย่างไรว่า Ti4+ เข้าไปอยู่ในโครงสร้าง MFI
ถ้า Ti4+ เข้าไปอยู่ในโครงสร้าง MFI จะทำให้เกิดพันธะคู่ระหว่างไอออน Ti4+ และอะตอมออกซิเจน (Ti=O) และจะดูดกลืนแสงอินฟราเรดที่เลขคลื่นประมาณ 960 cm-1 ไอออน Ti4+ เองหลังจากสร้างพันธะคู่กับออกซิเจนไปสองพันธะแล้ว ก็ยังเหลืออีกสองแขนในการสร้างพันธะเดี่ยวกับอะตอมออกซิเจนที่อยู่ข้างเคียงอีกสองอะตอม (ดูรูปข้างล่างประกอบ)

ในกรณีของ Al3+ หรือ Co (ไม่แน่ใจว่าเป็น +2 หรือ +3 เพราะทั้งสองชนิดมีเสถียรภาพในของแข็ง) ไม่คิดว่าจะเกิดพันธะคู่กับอะตอมออกซิเจนดังเช่น Ti4+ ได้ เพราะจะไม่เหลือแขนในการสร้างพันธะกับอะตอมออกซิเจนที่อยู่เคียงข้าง
6. Ti ที่อยู่ในโครงสร้างมี state เป็น +3 หรือ +4
จริงอยู่ที่ว่า Ti นั้นสามารถแสดงเลขออกซิเดชันเป็น +3 เช่นใน TiCl3 และ +4 เช่นใน TiCl4 หรือ TiO2 ได้ แต่ไม่มีการแสดงเลขออกซิเดชัน +3 ในรูป Ti2O3
ตามความรู้ที่ผมมี (จากหนังสือ Inorganic Chemistry หรือพวกคุณลองค้นจากอินเทอร์เนตดูเพื่อตรวจสอบก็ดีเหมือนกัน) Ti สามารถแสดงเลขออกซเดชัน +3 เป็นสารประกอบที่เสถียรได้ถ้าเป็นสารประกอบพวก TiCl3 หรือพวก organometallic compoud ต่าง ๆ แต่ไม่ใช่เป็นออกไซด์ ดังนั้น Ti ที่อยู่ในโครงสร้าง TS-1 จึงควรเป็น Ti+4 มากกว่า
ตัวที่มีปัญหาน่าจะเป็น Co เพราะมันมีสารประกอบออกไซด์ CoO (เกิดจาก Co2+) และ Co2O3 (เกิดจาก Co3+) ถ้าเป็น Co2+ ก็ไม่น่าจะเข้าไปอยู่ในโครงสร้าง แต่น่าจะอยู่ในรูปแบบการแลกเปลี่ยนประจุกับโปรตอนของตำแหน่งกรดบรอนสเตดบนพื้นผิว ซึ่งไอออนที่อยู่ด้วยการแลกเปลี่ยนประจุนี้สามารถเอาประจุอื่นเข้าไปแทนที่ได้ (ดังเช่นพวกที่ทำซีโอไลต์ที่จะมีการเปลี่ยนจาก Na-form เป็น H-form หรือเป็น NH4-form ด้วยการนำไปแช่ในสารละลายกรดหรือเบส) ดังนั้นตัวที่เห็นเหลืออยู่จากการล้างด้วยกรดจึงน่าจะเป็น Co3+ มากกว่า
หวังว่าการสอบที่จะเกิดขึ้นในวันอังคารที่ ๗ เมษายนนี้จะผ่านไปได้ด้วยดี
ตัวเร่งปฏิกิริยาและการทดสอบ
- การกำจัดสีเมทิลีนบลู
- การคำนวณพื้นที่ผิวแบบ Single point BET
- การคำนวณพื้นที่ผิวแบบ Single point BET ตอนที่ ๒ ผลกระทบจากความเข้มข้นไนโตรเจนที่ใช้
- การจำแนกตำแหน่งที่เป็นกรด Brönsted และ Lewis บนพื้นผิวของแข็งด้วยเทคนิค Infrared spectroscopy และ Adsorbed probe molecules
- การจำแนกตำแหน่งที่เป็นเบส Brönsted และ Lewis บนพื้นผิวของแข็งด้วยเทคนิค Infrared spectroscopy และ Adsorbed probe molecules
- การใช้ข้อต่อสามทางผสมแก๊ส
- การใช้ Avicel PH-101 เป็น catalyst support
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๑ ขั้นตอนของการเกิดปฏิกิริยาบนตัวเร่งปฏิกิริยาวิวิธพันธ์
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๒ การดูดซับบนพื้นผิวของแข็ง
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๓ แบบจำลองไอโซเทอมการดูดซับของ Freundlich
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๔ แบบจำลองไอโซเทอมการดูดซับของ Langmuir
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๕ แบบจำลองไอโซเทอมการดูดซับของ Temkin
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๖ แบบจำลองไอโซเทอมการดูดซับของ BET
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๗ ตัวอย่างไอโซเทอมการดูดซับของ BET
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๘ ตัวอย่างไอโซเทอมการดูดซับของ BET (๒)
- การดูดซับบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๙ ตัวอย่างไอโซเทอมการดูดซับของ BET (๓)
- การเตรียมตัวอย่างตัวเร่งปฏิกิริยาแบบผงให้เป็นแผ่นบาง
- การทดสอบตัวเร่งปฏิกิริยา - ผลแตกต่างหรือไม่แตกต่าง
- การทำปฏิกิริยา ๓ เฟสใน stirred reactor
- การบรรจุ inert material ใน fixed-bed
- การปรับ WHSV
- การปั่นกวนของแข็งให้แขวนลอยในของเหลว ตอนที่ ๑ ผลของความหนาแน่นที่แตกต่าง
- การปั่นกวนของแข็งให้แขวนลอยในของเหลว ตอนที่ ๒ ขนาดของ magnetic bar กับเส้นผ่านศูนย์กลางภาชนะ
- การปั่นกวนของแข็งให้แขวนลอยในของเหลว ตอนที่ ๓ ผลของรูปร่างภาชนะ
- การผสมแก๊สอัตราการไหลต่ำเข้ากับแก๊สอัตราการไหลสูง
- การระบุชนิดโลหะออกไซด์
- การลาก smooth line เชื่อมจุด
- การเลือกค่า WHSV (Weight Hourly Space Velocity) สำหรับการทดลอง
- การวัดความเป็นกรดบนพื้นผิวของแข็ง (อีกครั้ง)
- การวัดปริมาณตำแหน่งที่เป็นกรด-เบสบนพื้นผิวของแข็งด้วย GC
- การวัดปริมาณตำแหน่งที่เป็นกรด-เบสบนพื้นผิวของแข็งด้วย GC (๒)
- การวัดพื้นที่ผิว BET
- การวิเคราะห์ความเป็นกรดบนพื้นผิวของแข็ง ด้วยเทคนิคการดูดซับ Probe molecule (๑)
- การวิเคราะห์ความเป็นกรดบนพื้นผิวของแข็ง ด้วยเทคนิคการดูดซับ Probe molecule (๒)
- การวิเคราะห์ความเป็นกรดบนพื้นผิวของแข็ง ด้วยเทคนิคการดูดซับ Probe molecule (๓)
- การวิเคราะห์ความเป็นกรดบนพื้นผิวของแข็ง ด้วยเทคนิคการดูดซับ Probe molecule (๔)
- การวิเคราะห์ความเป็นกรดบนพื้นผิวของแข็ง ด้วยเทคนิคการดูดซับ Probe molecule (๕)
- การวิเคราะห์ความเป็นกรดบนพื้นผิวของแข็ง ด้วยเทคนิคการดูดซับ Probe molecule (๖)
- การไหลผ่าน Straightening vane และโมโนลิท (Monolith)
- เก็บตกจากการประชุมวิชาการ ๒๕๕๗ ตอนที่ ๑
- เก็บตกจากการประชุมวิชาการ ๒๕๕๗ ตอนที่ ๒
- เก็บตกจากการประชุมวิชาการ ๒๕๖๘
- ข้อควรระวังเมื่อใช้ออกซิเจนความเข้มข้นสูง
- ข้อพึงระวังในการแปลผลการทดลอง
- ค่า signal to noise ratio ที่ต่ำที่สุด
- จลนศาสตร์การเกิดปฏิกิริยาบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๑ Volcano principle
- จลนศาสตร์การเกิดปฏิกิริยาบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๒ แบบจำลอง Langmuir
- จลนศาสตร์การเกิดปฏิกิริยาบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๓ แบบจำลอง Langmuir-Hinshelwood
- จลนศาสตร์การเกิดปฏิกิริยาบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๔ แบบจำลอง Eley-Rideal
- จลนศาสตร์การเกิดปฏิกิริยาบนพื้นผิวตัวเร่งปฏิกิริยาวิวิธพันธ์ ตอนที่ ๕ แบบจำลอง REDOX
- ตอบคำถามเรื่องการเตรียมตัวเร่งปฏิกิริยา
- ตัวเลขมันสวย แต่เชื่อไม่ได้
- ตัวเลขไม่ได้ผิดหรอก คุณเข้าใจนิยามไม่สมบูรณ์ต่างหาก
- ตัวไหนดีกว่ากัน (Catalyst)
- แต่ละจุดควรต่างกันเท่าใด
- ท่อแก๊สระบบ acetylene hydrogenation
- น้ำหนักหายได้อย่างไร
- ปฏิกิริยาการเติมไฮโดรเจนและการแทนที่ไฮโดรเจนของอะเซทิลีน
- ปฏิกิริยาอันดับ 1 หรือปฏิกิริยาอันดับ 2
- ปฏิกิริยาเอกพันธ์และปฏิกิริยาวิวิธพันธ์ในเบดนิ่ง
- ปั๊มสูบไนโตรเจนเหลวจากถังเก็บ
- ผลของแก๊สเฉื่อยต่อการเกิดปฏิกิริยา
- เผาในเตาแบบไหนดี (Calcination)
- พลังงานกระตุ้นกับปฏิกิริยาคายความร้อนในเครื่องปฏิกรณ์เบดนิ่ง
- เมื่อแก๊สรั่วที่ rotameter
- เมื่อพีคออกซิเจนของระบบ DeNOx หายไป
- เมื่อเส้น Desorption isotherm ต่ำกว่าเส้น Adsorption isotherm
- เมื่อ base line เครื่อง chemisorb ไม่นิ่ง
- เมื่อ Mass Flow Controller คุมการไหลไม่ได้
- เรื่องของสุญญากาศกับ XPS
- สแกนกี่รอบดี
- สมดุลความร้อนรอบ Laboratory scale fixed-bed reactor
- สรุปการประชุมวันพฤหัสบดีที่ ๗ มกราคม ๒๕๕๓
- เส้น Cu Kα มี ๒ เส้น
- เห็นอะไรไม่สมเหตุสมผลไหมครับ
- อย่าลืมดูแกน Y
- อย่าให้ค่า R-squared (Coefficient of Determination) หลอกคุณได้
- อุณหภูมิกับการไหลของแก๊สผ่าน fixed-bed
- อุณหภูมิและการดูดซับ
- BET Adsorption-Desorption Isotherm Type I และ Type IV
- ChemiSorb 2750 : การเตรียมตัวอย่างเพื่อการวัดพื้นที่ผิว BET
- ChemiSorb 2750 : การวัดพื้นที่ผิวแบบ Single point BET
- ChemiSorb 2750 : ผลของอัตราการไหลต่อความแรงสัญญาณ
- Distribution functions
- Electron Spin Resonance (ESR)
- GHSV หรือ WHSV
- in situ กับ operando
- Ion-induced reduction ขณะทำการวิเคราะห์ด้วย XPS
- MO ตอบคำถาม การทดลอง gas phase reaction ใน fixed-bed
- MO ตอบคำถาม การวัดความเป็นกรด-เบสบนพื้นผิวของแข็ง
- Monolayer หรือความหนาเพียงชั้นอะตอมเดียว
- NH3-TPD - การลาก base line
- NH3-TPD - การลาก base line (๒)
- NH3-TPD - การไล่น้ำและการวาดกราฟข้อมูล
- NH3-TPD ตอน ตัวอย่างผลการวิเคราะห์ ๑
- NH3-TPD ตอน ตัวอย่างผลการวิเคราะห์ ๒
- Physisorption isotherms Type I และ Type IV
- Scherrer's equation
- Scherrer's equation (ตอนที่ 2)
- Scherrer's equation (ตอนที่ ๓)
- Scherrer's equation (ตอนที่ ๔)
- Supported metal catalyst และ Supported metal oxide catalyst
- Temperature programmed reduction ด้วยไฮโดรเจน (H2-TPR)
- Temperature programmed reduction ด้วยไฮโดรเจน (H2-TPR) ภาค ๒
- UV-Vis - peak fitting
- XPS ตอน การแยกพีค Mo และ W
- XPS ตอน จำนวนรอบการสแกน
- XRD - peak fitting
คณิตศาสตร์สำหรับวิศวกรรมเคมี
- การแก้ปัญหาสมการเชิงอนุพันธ์สามัญปัญหาเงื่อนไขค่าเริ่มต้นด้วยระเบียบวิธี Bogacki-Shampine และ Predictor-Evaluator-Corrector-Evaluator (PECE)
- การแก้ปัญหาสมการอนุพันธ์สามัญ ด้วย ODE solvers ของ GNU Octave ตอนที่ ๑
- การแก้ปัญหาสมการอนุพันธ์สามัญ ด้วย ODE solvers ของ GNU Octave ตอนที่ ๒
- การแก้ปัญหาสมการอนุพันธ์สามัญ ด้วย ODE solvers ของ GNU Octave ตอนที่ ๓
- การแก้สมการเชิงอนุพันธ์สามัญด้วยการใช้ Integrating factor
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๑)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๑๐)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๑๑)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๑๒)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๑๓)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๒)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๓)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๔)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๕)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๖)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๗)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๘)
- การแก้สมการอนุพันธ์ด้วยฟังก์ชันพหุนาม (๙)
- การคำนวณค่าฟังก์ชันพหุนาม
- การปรับเรียบ (Smoothing) ข้อมูล (ตอนที่ ๑)
- การปรับเรียบ (Smoothing) ข้อมูล (ตอนที่ ๒)
- การปรับเรียบ (Smoothing) ข้อมูล (ตอนที่ ๓)
- การหาความสัมพันธ์ระหว่างตัวแปร x และ y
- ข้อพึงระวังในการใช้ฟังก์ชันพหุนามในการประมาณค่าในช่วง
- ข้อพึงระวังในการใช้ฟังก์ชันพหุนามในการประมาณค่าในช่วง (๒)
- ข้อพึงระวังในการใช้ฟังก์ชันพหุนามในการประมาณค่าในช่วง (๒) (pdf)
- ข้อพึงระวังในการใช้ฟังก์ชันพหุนามในการประมาณค่าในช่วง (๓)
- ข้อสอบเก่าชุดที่ ๑
- ข้อสอบเก่าชุดที่ ๒
- ค่าคลาดเคลื่อน (error)
- จำนวนที่น้อยที่สุดที่เมื่อบวกกับ 1 แล้วได้ผลลัพธ์ไม่ใช่ 1
- โจทย์ผิดหรือถูกคะ??
- ใช่ว่าคอมพิวเตอร์จะคิดเลขถูกเสมอไป
- ตัวเลขที่เท่ากันแต่ไม่เท่ากัน
- ตัวอย่างการแก้ปัญหา สมการพีชคณิตไม่เชิงเส้นด้วยระเบียบวิธีนิวตัน-ราฟสัน
- ตัวอย่างการแก้ปัญหา สมการพีชคณิตไม่เชิงเส้นด้วยระเบียบวิธี Müller และ Inverse quadratic interpolation
- ตัวอย่างการแก้ปัญหา สมการพีชคณิตไม่เชิงเส้นด้วยระเบียบวิธี successive iteration
- ตัวอย่างการแก้ปัญหา สมการพีชคณิตไม่เชิงเส้นด้วยระเบียบวิธี successive iteration (pdf)
- ตัวอย่างการแก้ปัญหา สมการพีชคณิตไม่เชิงเส้นด้วย Function fzero ของ GNU Octave
- ตัวอย่างการคำนวณหาพื้นที่ใต้กราฟ ด้วยระเบียบวิธี Gaussian quadrature
- ตัวอย่างการคำนวณหาพื้นที่ใต้กราฟ ด้วยระเบียบวิธี Gaussian quadrature (pdf)
- ตัวอย่างผลของรูปแบบสมการต่อคำตอบของ ODE-IVP
- ตัวอย่างเพิ่มเติมบทที่ ๑
- ตัวอย่างเพิ่มเติมบทที่ ๒
- ตัวอย่างเพิ่มเติมบทที่ ๓
- ตัวอย่างเพิ่มเติมบทที่ ๔
- ทบทวนเรื่องการคูณเมทริกซ์
- ทบทวนเรื่อง Taylor's series
- ทศนิยมลงท้ายด้วยเลข 5 จะปัดขึ้นหรือปัดลง
- บทที่ ๑ การคำนวณตัวเลขในระบบทศนิยม
- บทที่ ๒ การแก้ปัญหาระบบสมการพีชคณิตเชิงเส้น
- บทที่ ๓ การแก้ปัญหาระบบสมการพีชคณิตไม่เชิงเส้น
- บทที่ ๔ การประมาณค่าในช่วง
- บทที่ ๕ การหาค่าอนุพันธ์
- บทที่ ๖ การหาค่าอินทิกรัล
- บทที่ ๗ การแก้ปัญหาสมการเชิงอนุพันธ์สามัญ ระบบสมการปัญหาเงื่อนไขค่าเริ่มต้น
- บทที่ ๘ การแก้ปัญหาสมการเชิงอนุพันธ์สามัญ ระบบสมการปัญหาเงื่อนไขค่าขอบเขต
- บทที่ ๙ การแก้ปัญหาสมการเชิงอนุพันธ์ย่อย
- ปฏิกิริยาคายความร้อนใน CSTR (ตอนที่ ๑)
- ปฏิกิริยาคายความร้อนใน CSTR (ตอนที่ ๒)
- เปรียบเทียบการแก้ปัญหาสมการพีชคณิตไม่เชิงเส้นด้วย solver ของ GNU Octave
- เปรียบเทียบการแก้ Stiff equation ด้วยระเบียบวิธี Runge-Kutta และ Adam-Bashforth
- เปรียบเทียบระเบียบวิธี Runge-Kutta
- เปรียบเทียบ Gauss elimination ที่มีและไม่มีการทำ Pivoting
- เปรียบเทียบ Gauss elimination ที่มีและไม่มีการทำ Pivoting (Spreadsheet)
- ฟังก์ชันแกมมา (Gamma function) และ ฟังก์ชันเบสเซล (Bessel function)
- เมื่อ 1 ไม่เท่ากับ 0.1 x 10
- ระเบียบวิธี Implicit Euler และ Crank-Nicholson กับ Stiff equation
- เลขฐาน ๑๐ เลขฐาน ๒ จำนวนเต็ม จำนวนจริง
- Distribution functions
- LU decomposition ร่วมกับ Iterative improvement
- LU decomposition ร่วมกับ Iterative improvement (pdf)
- Machine precision กับ Machine accuracy
เคมีสำหรับวิศวกรเคมี
- กรด-เบส : อ่อน-แก่
- กรด-เบส : อะไรควรอยู่ในบิวเรต
- กราฟการไทเทรตกรดกำมะถัน (H2SO4)
- กราฟการไทเทรตกรดกำมะถัน (H2SO4) ตอนที่ ๒
- กราฟการไทเทรตกรดที่ให้โปรตอนได้ ๒ ตัว
- กราฟการไทเทรตกรดที่ให้โปรตอนได้ ๓ ตัว
- กราฟการไทเทรตกรดไฮโปคลอรัส (HOCl)
- กราฟอุณหภูมิการกลั่นของน้ำมันเบนซิน (Gasoline distillation curve)
- กลิ่นกับอันตรายของสารเคมี
- การกำจัดสีเมทิลีนบลู
- การเกิดปฏิกิริยาเคมี
- การเจือจางไฮโดรคาร์บอนในน้ำ
- การใช้ pH probe
- การใช้ Tetraethyl lead นอกเหนือไปจากการเพิ่มเลขออกเทน
- การดูดกลืนคลื่นแสงของแก้ว Pyrex และ Duran
- การดูดกลืนแสงสีแดง
- การเตรียมสารละลายด้วยขวดวัดปริมาตร
- การเตรียมหมู่เอมีนและปฏิกิริยาของหมู่เอมีน (การสังเคราะห์ฟีนิลบิวตาโซน)
- การทำน้ำให้บริสุทธิ์สำหรับห้องปฏิบัติการ
- การทำปฏิกิริยาของโพรพิลีนออกไซด์ (1,2-Propylene oxide) ตอนที่ ๑
- การทำปฏิกิริยาของโพรพิลีนออกไซด์ (1,2-Propylene oxide) ตอนที่ ๒
- การทำปฏิกิริยาของหมู่ Epoxide ในโครงสร้าง Graphene oxide
- การทำปฏิกิริยาต่อเนื่องของผลิตภัณฑ์
- การเทของเหลวใส่บิวเรต
- การไทเทรต 1,1-Diamino-2,2-dinitroethene (FOX-7)
- การน๊อคของเครื่องยนต์แก๊สโซลีน และสารเพิ่มเลขออกเทนของน้ำมัน
- การเปลี่ยนพลาสติกเป็นน้ำมัน
- การเปลี่ยนเอทานอล (Ethanol) ไปเป็นอะเซทัลดีไฮด์ (Acetaldehyde)
- การเรียกชื่อสารเคมี
- การลดการระเหยของของเหลว
- การละลายของแก๊สในเฮกเซน (Ethylene polymerisation)
- การละลายเข้าด้วยกันของโมเลกุลมีขั้ว-ไม่มีขั้ว
- การวัดความเป็นกรดบนพื้นผิวของแข็ง (อีกครั้ง)
- การวัดปริมาณ-ความแรงของตำแหน่งที่เป็นกรดบนพื้นผิว
- การวัดปริมาณตำแหน่งที่เป็นกรด-เบสบนพื้นผิวของแข็งด้วย GC
- การวัดปริมาตรของเหลว
- การหาความเข้มข้นสารละลายมาตรฐานกรด
- การหาจุดสมมูลของการไทเทรตจากกราฟการไทเทรต
- การอ่านผลการทดลองการไทเทรตกรด-เบส
- การอ่านผลการทดลองการไทเทรตกรด-เบส (ตอนที่ ๒)
- การอ่านผลการทดลองการไทเทรตกรด-เบส (ตอนที่ ๓)
- แก๊สมัสตาร์ดกับกลิ่นทุเรียน
- ข้อควรระวังเมื่อใช้ออกซิเจนความเข้มข้นสูง
- คลื่นแม่เหล็กไฟฟ้ากับงานเคมีวิเคราะห์
- ความกระด้าง (Hardness) ของน้ำกับปริมาณของแข็งทั้งหมด ที่ละลายอยู่ (Total Dissolved Solid - TDS)
- ความดันกับการเกิดปฏิกิริยาเคมี
- ความเป็นกรดของหมู่ไฮดรอกซิล (Hydroxyl group) ตอนที่ ๑
- ความเป็นกรดของหมู่ไฮดรอกซิล (Hydroxyl group) ตอนที่ ๒
- ความเป็นกรดของอัลฟาไฮโดรเจนอะตอม (alpha-Hydrogen atom) ตอน กรดบาร์บิทูริก (Barbituric acid)
- ความเป็นกรดของอัลฟาไฮโดรเจนอะตอม (alpha-Hydrogen atoms)
- ความเป็นขั้วบวกของอะตอม C และการทำปฏิกิริยาของอีพิคลอโรไฮดริน (epichlorohydrin)
- ความเป็นไอออนิก (Percentage ionic character)
- ความสัมพันธ์ระหว่างสีกับชนิดและปริมาณธาตุ
- ความสำคัญของเคมีวิเคราะห์และเคมีอินทรีย์ในงานวิศวกรรมเคมี
- ความเห็นที่ไม่ลงรอยกับโดเรมี่
- ค้างที่ปลายปิเปตไม่เท่ากัน
- คำตอบของ Cubic equation of state
- จากกลีเซอรอล (glycerol) ไปเป็นอีพิคลอโรไฮดริน (epichlorohydrin)
- จากเบนซาลดีไฮด์ (Benzaldehyde) ไปเป็นกรดเบนซิลิก (Benzilic acid)
- จากโอเลฟินส์ถึงพอลิอีเทอร์ (From olefins to polyethers)
- จาก Acetone เป็น Pinacolone
- จาก Alkanes ไปเป็น Aramids
- จาก Aniline ไปเป็น Methyl orange
- จาก Benzene ไปเป็น Butter yellow
- จาก Hexane ไปเป็น Nylon
- จาก Toluene และ m-Xylene ไปเป็นยาชา
- ดำหรือขาว
- ไดโพรพิลเอมีน (Dipropylamine)
- ตกค้างเพราะเปียกพื้นผิว
- ตอบคำถามแบบแทงกั๊ก
- ตอบคำถามให้ชัดเจนและครอบคลุม
- ตำราสอนการใช้ปิเปตเมื่อ ๓๓ ปีที่แล้ว
- ไตรเอทานอลเอมีน (Triethanolamine)
- ถ่านแก๊ส หินแก๊ส แก๊สก้อน
- ทอดไข่เจียวให้อร่อยต้องใช้น้ำมันหมู
- ทำไมน้ำกระด้างจึงมีฟอง
- ที่แขวนกล้วย
- เท่ากับเท่าไร
- โทลูอีน (Toluene)
- ไทโอนีลคลอไรด์ (Thionyl chloride)
- นานาสาระเคมีวิเคราะห์
- น้ำด่าง น้ำอัลคาไลน์ น้ำดื่ม
- น้ำดื่ม (คิดสักนิดก่อนกดแชร์ เรื่องที่ ๑๑)
- น้ำตาลทราย ซูคราโลส และยาคุมกำเนิดสำหรับผู้ชาย
- น้ำบริสุทธิ์ (Purified water)
- ไนโตรเจนเป็นแก๊สเฉื่อยหรือไม่
- บีกเกอร์ 250 ml
- แบบทดสอบก่อนเริ่มเรียนวิชาเคมีสำหรับนิสิตวิศวกรรมเคมี
- ปฏิกิริยาการเติมไฮโดรเจนและการแทนที่ไฮโดรเจนของอะเซทิลีน (Hydrogenation and replacement of acetylenic hydrogen)
- ปฏิกิริยาการผลิต Vinyl chloride
- ปฏิกิริยาการออกซิไดซ์
- ปฏิกิริยา alpha halogenation และการสังเคราะห์ tertiary amine
- ปฏิกิริยา ammoxidation หมู่เมทิลที่เกาะอยู่กับวงแหวนเบนซีน
- ปฏิกิริยา Benzene alkylation
- ปฏิกิริยา Dehydroxylation
- ปฏิกิริยา Electrophilic substitution ของ m-Xylene
- ปฏิกิริยา Nucleophilic substitution ของสารประกอบ Organic halides
- ประโยชน์ของ Nitric oxide ในทางการแพทย์
- ปัญหาการสร้าง calibration curve ของ ICP
- ปัญหาการหาความเข้มข้นสารละลายกรด
- ปัญหาของไฮโดรคาร์บอนไม่อิ่มตัว
- โป้ง ชี้ กลาง นาง ก้อย
- ผลของค่าพีเอชต่อสีของสารละลายเปอร์แมงกาเนต
- ผลของอุณหภูมิต่อการแทนที่ตำแหน่งที่ 2 บนวงแหวนเบนซีน
- ฝึกงานภาคฤดูร้อน ๒๕๕๓ ตอนที่ ๑ อธิบายศัพท์
- พีคเหมือนกันก็แปลว่ามีหมู่ฟังก์ชันเหมือนกัน
- ฟลูออรีนหายไปไหน
- ฟอสฟอรัสออกซีคลอไรด์ (Phosphorus Oxychloride)
- ฟีนอล แอซีโทน แอสไพริน พาราเซตามอล สิว โรคหัวใจ และงู
- มุมมองที่ถูกจำกัด
- เมทานอลกับเจลล้างมือ
- เมื่อคิดในรูปของ ...
- เมื่อตำรายังพลาดได้ (Free radical polymerisation)
- เมื่อน้ำเพิ่มปริมาตรเองได้
- เมื่อหมู่คาร์บอนิล (carbonyl) ทำปฏิกิริยากันเอง
- รังสีเอ็กซ์
- เรื่องของสไตรีน (คิดสักนิดก่อนกด Share เรื่องที่ ๑)
- แลปการไทเทรตกรด-เบส ภาคการศึกษาต้น ปีการศึกษา ๒๕๖๐
- ศัพท์เทคนิค-เคมีวิเคราะห์
- สรุปคำถาม-ตอบการสอบวันศุกร์ที่ ๓ เมษายน ๒๕๕๒
- สีหายไม่ได้หมายความว่าสารหาย
- เสถียรภาพของอนุมูลอิสระ (๑)
- เสถียรภาพของอนุมูลอิสระ (๒)
- เสถียรภาพของอนุมูลอิสระ (๓)
- หมู่ทำให้เกิดสี (chromophore) และหมู่เร่งสี (auxochrome)
- หลอกด้วยข้อสอบเก่า
- อะเซทิลีน กลีเซอรีน และไทออล
- อะโรมาติก : การผลิต การใช้ประโยชน์ และปัญหา
- อัลคิลเอมีน (Alkyl amines) และ อัลคิลอัลคานอลเอมีน (Alkyl alkanolamines)
- อีเทอร์กับการเกิดสารประกอบเปอร์ออกไซด์
- อุณหภูมิ อัตราการเกิดปฏิกิริยา สมดุลเคมี
- เอา 2,2-dimethylbutane (neohexane) ไปทำอะไรดี
- เอาเบนซีนกับเอทานอลไปทำอะไรดี
- เอา isopentane ไปทำอะไรดี
- เอา maleic anhydride ไปทำอะไรดี
- เอา pentane ไปทำอะไรดี
- ไอโซเมอร์ (Isomer)
- ไฮโดรเจนเปอร์ออกไซด์กับพอลิโพรพิลีน
- Acentric factor
- Aldol condensation กับ Cannizzaro reaction
- Aldol condesation ระหว่าง Benzaldehyde กับ Acetone
- A-Level เคมี ปี ๖๖ ข้อพอลิเอทิลีน
- A-Level เคมี ปี ๖๘ ข้อการแยกสารด้วยการกลั่น
- Beilstein test กับเตาแก๊สที่บ้าน
- Benzaldehyde กับปฏิกิริยา Nitroaldol
- BOD และ COD
- BOD หรือ DO
- Carbocation - การเกิดและเสถียรภาพ
- Carbocation - การทำปฏิกิริยา
- Carbocation ตอนที่ ๓ การจำแนกประเภท-เสถียรภาพ
- Chloropicrin (Trichloronitromethane)
- Compressibility factor กับ Joule-Thomson effect
- Conjugated double bonds กับ Aromaticity
- Cubic centimetre กับ Specific gravity
- Dehydration, Esterification และ Friedle-Crafts Acylation
- Electrophilic addition ของอัลคีน
- Electrophilic addition ของอัลคีน (๒)
- Electrophilic addition ของ conjugated diene
- Electrophilic substitution ตำแหน่งที่ 1 บนวงแหวนเบนซีน
- Electrophilic substitution ตำแหน่งที่ 2 บนวงแหวนเบนซีน ตอน ผลของอุณหภูมิการทำปฏิกิริยา
- Electrophilic substitution ตำแหน่งที่ 3 บนวงแหวนเบนซีน
- Electrophilic substitution ตำแหน่งที่ 3 บนวงแหวนเบนซีน ตอน การสังเคราะห์ 2,4-Dinitrophenol
- Esterification of hydroxyl group
- Gibbs Free Energy กับการเกิดปฏิกิริยาและการดูดซับ
- Halogenation ของ alkane
- Halogenation ของ alkane (๒)
- HCl ก่อน ตามด้วย H2SO4 แล้วจึงเป็น HNO3
- I2 ในสารละลาย KI กับไฮโดรคาร์บอนอิ่มตัว
- Infrared spectrum interpretation
- Interferometer
- IR spectra ของโทลูอีน (Toluene) เอทิลเบนซีน (Ethylbenzene) โพรพิลเบนซีน (Propylbenzene) และคิวมีน (Cumene)
- IR spectra ของเบนซีน (Benzene) และไซลีน (Xylenes)
- IR spectra ของเพนทีน (Pentenes)
- Kjeldahl nitrogen determination method
- Malayan emergency, สงครามเวียดนาม, Seveso และหัวหิน
- MO ตอบคำถาม การวัดความเป็นกรด-เบสบนพื้นผิวของแข็ง
- Nucleophile กับ Electrophile
- PAT2 เคมี ปี ๖๕ ข้อการไทเทรตกรดเบส
- Peng-Robinson Equation of State
- Phenol, Ether และ Dioxin
- Phospharic acid กับ Anhydrous phosphoric acid และ Potassium dioxide
- pH Probe
- Picric acid (2,4,6-Trinitrophenol) และ Chloropicrin
- PV diagram กับการอัดแก๊ส
- Pyrophoric substance
- Reactions of hydroxyl group
- Reactions of hydroxyl group (ตอนที่ ๒)
- Redlich-Kwong Equation of State
- Redlich-Kwong Equation of State (ตอนที่ ๒)
- Soave-Redlich-Kwong Equation of State
- Standard x-ray powder diffraction pattern ของ TiO2
- Sulphur monochloride และ Sulphur dichloride
- Thermal cracking - Thermal decomposition
- Thiols, Thioethers และ Dimethyl thioether
- Van der Waals' Equation of State
- Vulcanisation
ประสบการณ์ Gas chromatograph/Chromatogram
- 6 Port sampling valve
- กระดาษความร้อน (thermal paper) มี ๒ หน้า
- การแก้ปัญหา packing ในคอลัมน์ GC อัดตัวแน่น
- การฉีดแก๊สเข้า GC ด้วยวาล์วเก็บตัวอย่าง
- การฉีดตัวอย่างที่เป็นของเหลวด้วย syringe
- การฉีด GC
- การใช้ syringe ฉีดตัวอย่างที่เป็นแก๊ส
- การดึงเศษท่อทองแดงที่หักคา tube fitting ออก
- การตั้งอุณหภูมิคอลัมน์ GC
- การติดตั้ง Integrator ให้กับ GC-8A เพื่อวัด CO2
- การเตรียมคอลัมน์ GC ก่อนการใช้งาน
- การปรับความสูงพีค GC
- การวัดปริมาณไฮโดรเจนด้วย GC-TCD
- ข้อสังเกตเกี่ยวกับ FPD (ตอนที่ ๒)
- ข้อสังเกตเกี่ยวกับ FPD (Flame Photometric Detector)
- โครมาโทกราฟแยกสารได้อย่างไร
- ชนิดคอลัมน์ GC
- ตรวจโครมาโทแกรม ก่อนอ่านต้วเลข
- ตัวอย่างการแยกพีค GC ที่ไม่เหมาะสม
- ทำความรู้จักกับ Chromatogram ตอนที่ ๑
- ทำความรู้จักกับ Chromatogram ตอนที่ ๒
- ทำความรู้จักกับ Chromatogram ตอนที่ ๓
- ทำความรู้จักกับ Chromatogram ตอนที่ ๔
- ทำความรู้จักกับ Chromatogram ตอนที่ ๕
- ทำความรู้จักกับ Chromatogram ตอนที่ ๖
- ทำไมพีคจึงลากหาง
- ผลกระทบของน้ำที่มีต่อการวัดคาร์บอนไดออกไซด์ ตอนที่ ๑
- ผลกระทบของน้ำที่มีต่อการวัดคาร์บอนไดออกไซด์ ตอนที่ ๒
- ผลกระทบของน้ำที่มีต่อการวัดคาร์บอนไดออกไซด์ ตอนที่ ๓
- พีคที่เกิดจากปฏิกิริยาระหว่างน้ำกับ packing ในคอลัมน์ GC
- พีคประหลาดจากการใช้อากาศน้อยไปหน่อย
- มันไม่เท่ากันนะ
- เมื่อความแรงของพีค GC ลดลง
- เมื่อจุดไฟ FID ไม่ได้
- เมื่อพีค GC หายไป
- เมื่อพีค GC ออกมาผิดเวลา
- เมื่อพีค GC ออกมาผิดเวลา(อีกแล้ว)
- เมื่อพีค HPLC ออกมาผิดเวลา
- เมื่อเพิ่มความดันอากาศให้กับ FID ไม่ได้
- เมื่อ GC ถ่านหมด
- เมื่อ GC มีพีคประหลาด
- ลากให้ผ่านหรือไม่ให้ผ่าน
- สัญญาณจาก carrier gas รั่วผ่าน septum
- สารพัดปัญหา GC
- สิ่งปนเปื้อนในน้ำ DI
- สิ่งปนเปื้อนในน้ำ DI (ตอนที่ ๒)
- Chromatograph principles and practices
- Flame Ionisation Detector
- GC-2014 ECD & PDD ตอนที่ ๗ ข้อสังเกตเกี่ยวกับ ECD (Electron Capture Detector)
- GC detector
- GC - peak fitting ตอนที่ ๑ การหาพื้นที่พีคที่เหลื่อมทับ
- GC principle
- LC detector
- LC principle
- MO ตอบคำถาม การแยกพีค GC ด้วยโปรแกรม fityk
- MO ตอบคำถาม สารพัดปัญหาโครมาโทแกรม
- Relative Response Factors (RRF) ของสารอินทรีย์ กับ Flame Ionisation Detector (FID)
- Thermal Conductivity Detector
- Thermal Conductivity Detector ภาค 2
สินค้าที่ใช้ได้สองทาง (Dual-Use Items - DUI)
- การก่อการร้ายด้วยแก๊สซาริน (Sarin) ในรถไฟใต้ดินกรุงโตเกียว MO Memoir : Friday 6 September 2567
- การผลิตกรดไนตริกความเข้มข้นสูง
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๐ ฟังก์ชันเข้ารหัสรีโมทเครื่องปรับอากาศ
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๑ License key
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๒ สารเคมี (Chemicals)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๓ ไม่ตรงตามตัวอักษร (สารเคมี)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๔ ไม่ตรงตามตัวอักษร (Heat exchanger)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๕ Sony PlayStation
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๖ เส้นใยคาร์บอน (Carbon fibre)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๗ The Red Team : Centrifugal separator
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๘ The Blue Team : Spray drying equipment
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑๙ เครื่องสลายนิ่วในไตด้วยคลื่นกระแทก (Lithotripter)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๑ ตัวเก็บประจุ (Capacitor)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒๐ เรซินแลกเปลี่ยนไอออน (Ion-exchange resin)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒๑ ไม่ตรงตามตัวอักษร (Aluminium tube)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒๒ เครื่องกระตุกหัวใจด้วยไฟฟ้า (Defibrillator)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒๓ เครื่องยนต์ดีเซล
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒๔ มุมมองจากทางด้านเทคนิค
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒๕ Printed Circuit Board (PCB)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๒ เครื่องแลกเปลี่ยนความร้อน (Heat Exchanger)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๓ เครื่องแปลงความถี่ไฟฟ้า (Frequency Changer)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๔ อุปกรณ์เข้ารหัส (Encoding Device)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๕ Insulated Gate Bipolar Transistor (IGBT)
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๖ Toshiba-Kongsberg Incident
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๗ รายงานผลการทดสอบอุปกรณ์
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๘ Drawing อุปกรณ์
- การวินิจฉัยการเข้าข่ายสินค้าที่ใช้ได้สองทาง ตัวอย่างที่ ๙ ซอร์ฟแวร์ควบคุมการทำงานอุปกรณ์
- ความลับแตกเพราะทัวร์ผู้นำ (Pressure transducer)
- เครื่องแลกเปลี่ยนความร้อนสำหรับเตาปฏิกรณ์นิวเคลียร์
- แคลเซียม, แมกนีเซียม และบิสมัท กับการผลิตอาวุธทำลายล้างสูง
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๑
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๑๐
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๑๑
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๒
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๓
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๔
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๕
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๖
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๗
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๘
- สินค้าที่ใช้ได้สองทาง (Dual-Use Items : DUI) ตอนที่ ๙
- สินค้าที่ไม่ใช่ DUI ที่เป็นสินค้า DUI - ไตรบิวทิลฟอสเฟต (Tributyl phosphate)
- สินค้าที่ไม่ใช่ DUI ที่เป็นสินค้า DUI - Karl Fischer moisture equipment
API 2000 Venting Atmospheric and Low-Pressure Storage Tanks
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๐)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๑)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๒)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๓)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๔)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๕)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๖)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๗)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๘)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๑๙)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๒)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๒๐)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๒๑)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๒๒)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๓)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๔)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๕)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๖)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๗)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๘)
- API 2000 Venting Atmospheric and Low-Pressure Storage Tanks (ตอนที่ ๙)
โน๊ตเพลง
- "กำลังใจ" และ "ถึงเพื่อน"
- "ใกล้รุ่ง" และ "อาทิตย์อับแสง"
- "คนดีไม่มีวันตาย" "หนึ่งในร้อย (A Major) และ "น้ำตาแสงใต้ (A Major)"
- "ความฝันอันสูงสุด" และ "ยามเย็น"
- "จงรัก" และ "ความรักไม่รู้จบ"
- "ฉันยังคอย" และ "ดุจบิดามารดร"
- "ชาวดง" และ "ชุมนุมลูกเสือไทย"
- "ตัดใจไม่ลง" และ "ลาสาวแม่กลอง"
- "เติมใจให้กัน" และ "HOME"
- "แต่ปางก่อน" "ความรักไม่รู้จบ" "ไฟเสน่หา" และ "แสนรัก"
- "ทะเลใจ" "วิมานดิน" และ "เพียงแค่ใจเรารักกัน"
- "ที่สุดของหัวใจ" "รักล้นใจ" และ "รักในซีเมเจอร์"
- "ธรณีกรรแสง" และ "Blowin' in the wind"
- "นางฟ้าจำแลง" "อุษาสวาท" และ "หนี้รัก"
- "แผ่นดินของเรา" และ "แสงเทียน"
- "พรปีใหม่" และ "สายฝน"
- "พี่ชายที่แสนดี" "หลับตา" และ "หากรู้สักนิด"
- เพลงของโรงเรียนเซนต์คาเบรียล
- "มหาจุฬาลงกรณ์" "ยูงทอง" และ "ลาภูพิงค์"
- "ยังจำไว้" "บทเรียนสอนใจ" และ "ความในใจ"
- "ร่มจามจุรี" และ "เงาไม้"
- "ลมหนาว" และ "ชะตาชีวิต"
- "ลองรัก" และ "วอลซ์นาวี"
- "ลาแล้วจามจุรี"
- "วันเวลา" และ "โลกทั้งใบให้นายคนเดียว"
- "วิหคเหินลม" และ "พรานทะเล"
- "สายชล" และ "เธอ"
- "สายใย" และ "ความรัก"
- "สายลม" และ "ไกลกังวล"
- "สายลมเหนือ" และ "เดียวดายกลางสายลม"
- "หน้าที่ทหารเรือ" และ "ทหารพระนเรศวร"
- "หนึ่งในร้อย" และ "น้ำตาแสงใต้"
- "หากันจนเจอ" และ "ลมหายใจของกันและกัน"