"อาจารย์ตอบเหมือนกับที่โปรเฟสเซอร์ต่างประเทศเขาตอบเลย"
นิสิตป.เอกผู้นั้นพูดกับผม
ระหว่างการสนทนาหลังการสอบปกป้องวิทยานิพนธ์ของเขา
วันนั้นผมได้พบกับเขาหลังจากที่เขาเสร็จสิ้นการสอบปกป้องวิทยานิพนธ์ของเขา
ผมเองไม่ใช่กรรมการสอบของเขาหรอก
เพียงแต่ว่ารู้จักกันมาหลายปี
เขาเองก็แอบ ๆ
มาปรึกษาปัญหาเรื่องการทำการทดลองกับผมก็หลายครั้ง
(เขาทำการทดลองกับบริษัท)
ก็เลยถามสารทุกข์สุขดิบกันหน่อย
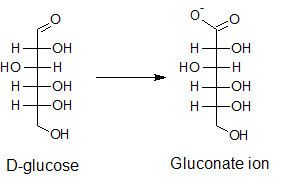
ปฏิกิริยาของเขานั้นเป็นการเติมไฮโดรเจนไปที่สารประกอบตัวหนึ่ง
บังเอิญว่ามีการพบว่าผลิตภัณฑ์ที่ได้นั้นมีการเปลี่ยนสีจากสีขาวไปเป็นสีอื่น
อันนี้เป็นปัญหาหนึ่งที่เขาตอบกรรมการไม่ได้
ทางอาจารย์ที่ปรึกษาวิทยานิพนธ์หลักก็บอกให้เขาไปหา
paper
มาอธิบาย
แต่ทางอาจารย์จากต่างประเทศ
(ที่เชิญมาเป็นอาจารย์ที่ปรึกษาร่วมและได้เดินทางมาสอบด้วย)
กลับบอกว่าไม่ต้อง
พร้อมทั้งอธิบายว่าการเกิดสีนั้นเกิดได้อย่างไร
หลังการสอบนิสิตผู้นั้นก็ได้เอาคำถามนั้นมาถามผม
ผมก็ตอบกลับไปว่าเรื่องนี้มันมีอยู่ในตำราอินทรีย์เคมีอยู่แล้ว
ไม่ต้องไปหา paper
อะไรมายืนยัน
ถ้ามีความรู้พื้นฐานเคมีอินทรีย์บ้างสักหน่อยก็ตอบได้แล้ว
มันอยู่ในเรื่อง chromophore
และ
auxochrome
ผมก็บอกเขาไปว่าคุณก็ต้องไปดูว่าสารตั้งต้นของคุณมีหมู่ฟังก์ชันอะไร
และในระหว่างการเกิดปฏิกิริยานั้นหมู่ฟังก์ชันต่าง
ๆ เหล่านั้นสามารถเปลี่ยนไปเป็นหมู่ใดได้
(ต้องพิจารณาปฏิกิริยาข้างเคียงประกอบด้วย)
และถ้าหมู่เหล่านั้นมันเป็น
chromophore
(หรือ
auxochrome)
มันก็ทำให้สีของสารของคุณนั้นเปลี่ยนแปลงไปได้
ที่น่าแปลกคือนิสิตบัณฑิตศึกษาส่วนใหญ่ในภาคของเราศึกษาปฏิกิริยาที่เกี่ยวข้องกับเคมีอินทรีย์
แต่ในวิชาสัมมนาพอถามคำถามพื้นฐานเกี่ยวข้องกับเคมีอินทรีย์ที่ใช้อธิบายผลการทดลองของเขาได้
กลับตอบไม่ได้ (เกือบ)
ทุกราย
จะอธิบายอะไรแต่ละทีก็บอกแต่ว่า
paper
เขาว่ามา
หรือแม้แต่ตัวอาจารย์ที่ปรึกษาเองก็มักจะใช้วิธีบอกว่า
paper
เขาว่ามา
ทั้งนี้อาจเป็นเพราะคิดไปเองว่าไม่ได้เรียนจบมาทางสายวิทยาศาสตร์โดยตรง
ดังนั้นจึงไม่จำเป็นต้องรู้เคมีอินทรีย์ให้ดี
เรื่องนี้มันก็พอจะรับได้อยู่หรอกถ้าทำหน้าที่เป็น
"วิศวกร"
ควบคุมการก่อสร้างหรือการผลิต
แต่ไม่เหมาะกับคนที่จะหน้าที่เป็น
"นักวิจัย"
และสำหรับคนที่ชอบตอบคำถามแบบ
"paper
เขาว่ามา"
เป็นประจำผมว่าอย่าเรียกตนเองว่าเป็น
"Researcher"
หรือ
"นักวิจัย"
เลย
เรียกว่าเป็น "Messenger"
หรือ
"พนักงานส่งเอกสาร"
น่าจะตรงกว่า
เพราะทำเพียงแค่เอาข้อมูลของคนหนึ่งไปให้อีกคนหนึ่ง
โดยที่ตัวเองเป็นคนอยู่ตรงกลางและไม่รู้เรื่องรู้ราวอะไรเลยเกี่ยวกับข้อมูลนั้นเลย
และเมื่อต้นสัปดาห์ที่แล้ว
ก็มีนิสิตป.ตรีคนหนึ่งมาคุยกับผมเรื่องสีของสารเคมี
คือเขาทำโครงงานเกี่ยวกับการฟอกสี
methylene
blue ในน้ำด้วยตัวเร่งปฏิกิริยาที่ใช้แสง
เขาบอกว่ามีอะไรที่มันคาใจอยู่หลายอย่าง
ผมก็บอกเขาไปว่าถ้าไม่อยากมีงานเพิ่มก็ให้มันคาใจไปอย่างนั้นแหละ
เอาเวลาไปทำวิชาอื่นดีกว่า
(เทอมหน้ายังมีการบ้านรออยู่อีกเยอะ)
แต่เรื่องนี้ผมเคยเขียนเอาไว้แล้วในเรื่อง
"สีหายไม่ได้หมายความว่าสารหาย"
(Memoir ปีที่
๔ ฉบับที่ ๓๗๓ วันพฤหัสบดีที่
๘ ธันวาคม พ.ศ.
๒๕๕๔)
ถ้าอยากรู้ก็ให้ลองไปอ่านดูเอาเอง
อาจจะพอช่วยให้หายข้อข้องใจบางข้อได้
อีกเรื่องหนึ่งที่เกี่ยวข้องกับเรื่องนี้คือ
"พอลิเมอร์นำไฟฟ้า"
(อ่านมาถึงตรงนี้คงจะงงนะว่ามันเกี่ยวข้องกันได้อย่างไร
แต่จะว่าไปแล้วมันมีพื้นฐานร่วมกันอยู่)
ที่มันมักจะมีสี
(มันไม่มีสีขาว)
ดังนั้นก่อนจะเข้าสู่เรื่องโครงสร้างของสารอินทรีย์ที่ทำให้เกิดสี
เราลองมาทบทวนพื้นฐานกันสักหน่อยว่าสารต่าง
ๆ นั้นมันมีสีได้อย่างไร
ผมเองก็ไม่ได้รู้เรื่องราวเหล่านี้ลึกซึ้งเท่าใดหรอก
เพียงแต่รู้ว่ารายละเอียดต่าง
ๆ เกี่ยวกับเรื่องเหล่านี้ควรไปศึกษาเพิ่มเติมจากที่ไหนแค่นั้นเอง
Memoir
อีก
๒ ฉบับที่เกี่ยวข้องกับเรื่องนี้คือ
แสงจากดวงอาทิตย์ในช่วงที่ตามองเห็นนั้นประกอบด้วยแสงที่มีความยาวคลื่นแตกต่างกัน
แต่ละช่วงความยาวคลื่นก็ให้สีที่ดวงตาของคนเรารับรู้ได้ที่แตกต่างกัน
การที่เรามองเห็นสิ่งใดนั้นเป็นเพราะมีแสงไปตกกระทบวัตถุชิ้นนั้น
(แสงในที่นี้คือแสงสีขาวที่เทียบเท่าแสงอาทิตย์
หรือแสงอาทิตย์)
แล้ววัตถุนั้นก็สะท้อนแสงมายังดวงตาของเรา
ถ้าหากแสงที่สะท้อนมายังดวงตาของเรานั้นมีครบทุกความยาวคลื่น
เราก็จะเห็นวัตถุนั้นมีสีขาว
ในทางตรงกันข้ามถ้าวัตถุนั้นดูดกลืนคลื่นแสงได้ทุกช่วงความยาวคลื่น
เราก็จะเห็นวัตถุนั้นมีสีดำ
แต่ถ้าวัตถุนั้นดูดกลืนคลื่นแสงเพียงบางช่วงความยาวคลื่น
เราก็จะมองเห็นวัตถุนั้นมีสีต่าง
ๆ สีที่เรามองเห็นคือช่วงความยาวคลื่นที่วัตถุนั้นไม่ดูดกลืน
ตัวอย่างเช่นการที่เราเห็นใบไม้เป็นสีเขียวก็เพราะสารเคมีที่อยู่ในใบไม้นั้นดูดกลื่นคลื่นแสงช่วงสีเหลือง-แดง
และช่วงน้ำเงิน-ม่วง
เอาไว้ ไม่ดูดกลืนคลื่นแสงสีเขียว
ดังนั้นเมื่อมีแสงแดดมาตกกระทบกับใบไม้
จะมีเฉพาะแสงสีเขียวเท่านั้นที่สะท้อนมายังดวงตาของเรา
เราจึงมองเห็นใบไม้เป็นสีเขียว
หลอดไฟแบบหลอดไส้ทังสเตนที่เป็นหลอดแก้วใสหรือขาวขุ่นนั้นจะให้โทนแสงสีเหลืองที่สว่างมาก
เพราะมันให้แสงในช่วงสีเหลืองมากกว่าช่วงคลื่นอื่น
แสงสีเหลืองจึงบดบังสีอื่นเอาไว้
แต่ถ้าต้องการให้แสงที่ออกมานั้นเป็นสีขาวก็ทำได้ด้วยการใช้แก้วสีน้ำเงินแทนการใช้แก้วใสหรือขาวขุ่น
(บางทีเรียกหลอดนี้ว่า
"หลอดเทียบสี"
เพราะมันทำให้มองเห็นสีไม่ผิดเพี้ยน)
สีน้ำเงินของหลอดแล้วจะดูดกลืนแสงสีเหลืองเอาไว้ส่วนหนึ่ง
ทำให้ความจ้าของแสงสีเหลืองลดลงไม่ไปบดบังแสงสีอื่นจนหมด
ทำให้แสงออกมาเป็นสีขาว
การดูดกลืนคลื่นแม่เหล็กไฟฟ้าในช่วงรังสีอุลตร้าไวโอเล็ต
(Ultraviolet
หรือย่อว่า
UV)
กับช่วงคลื่นแสงที่ตามองเห็น
(Visible
light หรือย่อว่า
Vis)
เกี่ยวข้องกับการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนในชั้นวงโคจรนอกของอะตอม
ซึ่งเป็นอิเล็กตรอนที่เกี่ยวข้องกับการสร้างพันธะทางเคมี
ถ้าพลังงานที่ต้องใช้ในการทำให้อิเล็กตรอนในชั้นวงโคจรนี้กระโดดไปยังระดับพลังงานที่สูงกว่านั้นอยู่ในช่วงพลังงานของแสง
UV
เมื่อมีแสงอาทิตย์มาตกกระทบสารดังกล่าว
สารนั้นก็จะไม่ดูดกลืนแสงในช่วงคลื่นที่ตามองเห็น
เราก็จะเห็นสารนั้นเป็นสีขาว
แต่ถ้ามีการดูดกลืนแสงในช่วงที่ตามองเห็นที่บางความยาวช่วงคลื่น
เราก็จะมองเห็นว่าสารนั้นมีสี
ซึ่งเป็นสีของช่วงคลื่นที่
"ไม่ถูก"
ดูดกลืน
ไอออนของโลหะทรานซิชันมักจะมีสีต่าง
ๆ เป็นเพราะไอออนของโลหะทรานซิชันนั้นมีระดับพลังงานในชั้น
d
หรือ
f
ที่ว่างและอยู่ใกล้กับระดับพลังงานของอิเล็กตรอนชั้นนอกสุดของไอออนนั้น
ทำให้อิเล็กตรอนนั้นไม่ต้องการพลังงานที่สูงในการกระโดดไปยังระดับพลังงานถัดไป
และพลังงานที่ต้องการดังกล่าวก็อยู่ในช่วงความยาวคลื่นแสงที่ตามองเห็น
ในกรณีของสารอินทรีย์นั้นแตกต่างออกไป
แต่มันก็เกี่ยวข้องกับการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนในส่วนของพันธะ
π
(bonding) หรืออิเล็กตรอนในส่วนของ
non-bonding
ไปยังระดับพลังงาน
π*
(anit-bonding)
เรื่องส่วนที่จะเขียนต่อไปนี้จะอิงจากหนังสือ
"A
short course in organic chemistry" โดย
Edward
E. Burgoyne ของสำนักพิมพ์
McGraw
Hill ฉบับพิมพ์ครั้งที่
๓ ปีค.ศ.
๑๙๘๕
(พ.ศ.
๒๕๒๘)
ในบทที่
๑๓ Amines,
Dyes and Alkaloids หัวข้อ
๑๓.๖
เรื่อง Color
in organic compounds หน้า
๔๐๐-๔๐๓
เป็นหลัก
ในปีค.ศ.
๑๘๗๖
(พ.ศ.
๒๔๑๙)
O. N. Witt สังเกตว่าหมู่ฟังก์ชันบางหมู่นั้นทำให้สารประกอบมีสี
เขาเรียกหมู่เหล่านั้นว่า
"Chromophore"
(โครโมฟอร์
หรือหมู่ทำให้เกิดสี)
และยังพบว่าความแรงในการทำให้เกิดสีของแต่ละหมูนั้นไม่เหมือนกัน
บางหมู่นั้นปรากฏเพียงหมู่เดียวในโมเลกุลก็ทำให้โมเลกุลมีสีได้
ในขณะนี้บางหมู่นั้นจำเป็นต้องมีจำนวนมากพอจึงจะทำให้โมเลกุลมีสี
ตัวอย่างหมู่ทำให้เกิดสีบางหมู่แสดงไว้ในตารางที่
๑ พึงสังเกตว่าหมู่ทุกหมู่ที่นำมาแสดงนั้นต่างมีพันธะ
π
โดยปรกติการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนในส่วนของพันธะ
π
(bonding) หรืออิเล็กตรอนในส่วนของ
lone-pair
non-bonding ไปยังระดับพลังงาน
π*
(anit-bonding) นั้นจะอยู่ในช่วงระดับพลังงานของรังสี
UV
แต่ก็มีการสังเกตว่าถ้าโมเลกุลนั้นมีระบบ
π
อิเล็กตรอนที่ใหญ่และอยู่ในรูปแบบที่เป็น
conjugated
double bond (พันธะคู่สลับกับพันธะเดี่ยว)
ความแตกต่างของระดับพลังงานดังกล่าวจะลดลง
และโมเลกุลจะเริ่มดูดกลืนคลื่นแสงที่มีความยาวคลื่นมากขึ้น
และถ้าระบบ conjugated
double bond นั้นใหญ่มากพอจนถึงระดับหนึ่ง
โมเลกุลสารนั้นจะเริ่มดูดกลืนคลื่นแสงในช่วงสีม่วง
ทำให้เราเริ่มเห็นสารนั้นเป็นสีเหลือง
(เช่น
β-carotene
ในรูปที่
๑ ที่ทำให้น้ำมันพืชมีสีเหลือง
เพราะมันดูดกลืนแสงสีม่วง
ไม่ดูดกลืนแสงสีเหลือง)
และถ้าระบบ
conjugated
double bond นั้นใหญ่มากขึ้นไปอีกจนกระทั่งโมเลกุลดูดกลืนแสงสีเหลืองได้
เราก็จะเห็นสารนั้นเป็นสีม่วงหรือสีน้ำเงิน
(เพราะมันดูดกลืนแสงสีเหลือง
ไม่ดูดกลืนแสงสีน้ำเงิน)
ระบบ
conjugated
double bond
นั้นบางทีก็เชื่อมต่อกันผ่านอะตอมที่มีอิเล็กตรอนคู่โดดเดี่ยว
(ที่อาจทำหน้าที่เป็นออกโซโครม)
หรือไม่ก็ไอออนของโลหะ
เช่นในกรณีของคลอโรฟิลล์
(chlorophyll)
ที่มีไอออน
Mg2+
ที่ทำให้มีสีเขียว
หรือฮีโมโกลบิน (hemoglobin)
ที่มีไอออน
Fe3+
ที่ทำให้มีสีแดง
รูปที่
๑ (บน)
β-carotene
ประกอบด้วย
conjugated
double bond จำนวนมาก
ทำให้โมเลกุลดูดกลืนแสงสีม่วงได้
เราจึงเห็นสารที่มี β-carotene
ประกอบอยู่เป็นสีเหลือง
(เช่นในน้ำมันพืช)
สารนี้ร่างกายสามารถเปลี่ยนไปเป็น
vitamin
A (ล่าง)
ได้ด้วยการตัดตรงกลางโมเลกุล
Witt
ยังสังเกตด้วยว่าถ้าวงแหวนเบนซีนที่เป็นส่วนหนึ่งของโครงสร้างโครโมฟอร์นั้นมีหมู่บางหมู่มาเกาะ
จะทำให้ความเข้มสีของสารนั้นเปลี่ยนไปแม้ว่าหมู่นั้นเองจะไม่ทำให้เกิดสี
เขาเรียกหมู่เหล่านี้ว่า
"Auxochrome"
(ออกโซโครม
หรือหมู่เร่งสี)
หมู่เหล่านี้ต่างเป็นหมู่จ่ายอิเล็กตรอนให้กับวงแหวนเบนซีน
และความสามารถในการเร่งสีนั้นก็เรียงลำดับเช่นเดียวกันกับความสามารถในการจ่ายอิเล็กตรอนให้กับวงแหวนเบนซีน
(พวกที่มีอิเล็กตรอนคู่โดดเดี่ยวและทำให้เกิดการแทนที่ที่ตำแหน่ง
ortho
หรือ
para)
กล่าวคือความสามารถในการเร่งสีของหมู่
R2N- > RHN- > H2N- > HO- > RO-
เวลาที่โครงสร้างของโครโมฟอร์หรือออกโซโครมนั้นเปลี่ยนแปลงไป
สีของสารนั้นก็จะเปลี่ยนไปด้วย
ตัวอย่างที่เห็นได้ชัดคืออินดิเคเตอร์ที่เราใช้ในการไทเทรตกรด-เบส
รูปที่
๒ ข้างล่างแสดงโมเลกุล Methyl
orange ที่มีสีเหลืองในรูปเบส
(ซ้าย
เมื่อ pH > 4.4) และมีสีแดงในรูปกรด
(ขวา
เมื่อ pH < 3.1) เมื่ออยู่ในน้ำ
จะเห็นว่าเมื่ออยู่ในรูปกรด
วงแหวนเบนซีน (ในกรอบสีแดง)
จะเปลี่ยนเป็นโครงสร้างแบบ
quinoid
ที่มีความแรงในการทำให้เกิดสีมากกว่า
(มีการดูดกลืนแสงที่มีความยาวคลื่นมากกว่าแสงสีม่วง
ทำให้เห็นสารเป็นสีแดงแทนที่จะเป็นสีเหลือง)
รูปกรดในที่นี้คือรูปที่อินดิเคเตอร์แสดงฤทธิ์เป็นกรด
(หรือพร้อมที่จะจ่ายโปรตอน)
ส่วนรูปแบบคือรูปที่อินดิเคเตอร์แสดงฤทธิ์เป็นเบส
(หรือพร้อมที่จะรับโปรตอน)
รูปที่
๒ โมเลกุล Methyl
orange
รูปที่
๓ แสดงโมเลกุล Bromocresol
green ที่มีสีเหลืองเมื่ออยู่ในรูปกรด
(pH < 3.8) และน้ำเงินเมื่ออยู่ในรูปเบส
(pH > 5.4) โดยเมื่ออยู่ในรูปเบสนั้นหมู่
-OH
(ของวงแหวนเบนซีนในกรอบสีแดง)
จะจ่ายโปรตอนออกไป
ทำให้โครงสร้างของวงแหวนเบนซีนเปลี่ยนเป็น
quinoid
ที่มีความแรงในการทำให้เกิดสีมากกว่า
(ดูดกลืนคลื่นแสงที่ความยาวคลื่นที่มากกว่า)
อะตอม
Br
ที่ปรากฏในโมเลกุลนั้นก็เป็นออกโซโครมตัวหนึ่งด้วย
รูปที่
๓ Bromocresol
green เหลือง
(acidic
form) เมื่อ
pH < 3.8 และน้ำเงิน
(basic
form) เมื่อ
pH > 5.4 (จาก
http://en.wikipedia.org/wiki/File:Bromocresol_green_ionic_equilibrium.png)
โมเลกุล
Phenolphthalein
(รูปที่
๔)
นั้นเมื่ออยู่ในสารละลายที่เป็นกรดจะประกอบด้วยวงแหวน
3
วงที่ไม่มีความเป็น
conjugated
double bond เชื่อมต่อกันระหว่างวง
ทำให้เป็นโมเลกุลที่ไม่มีสี
แต่เมื่อเจอกับเบส โมเลกุล
phenolphthalein
จะจ่ายโปรตอนออกไป
ทำให้โครงสร้างอะตอม C
(ในวงสีแดง)
เปลี่ยนแปลงไปทำให้เกิด
conjugated
double bond เชื่อมต่อวงแหวนต่าง
ๆ เข้าด้วยกันกลายเป็นระบบ
conjugated
double bond ขนาดใหญ่ขึ้น
โมเลกุลจึงมีสีม่วง
พึงสังเกตนะว่าโมเลกุลของ
phenolphthalein
เปลี่ยนสีระหว่างการมีสีกับไม่มีสีด้วยการเปลี่ยนแปลงโครงสร้างโมเลกุลเพียงนิดเดียว
เวลาที่เห็นใครทำการทดลองเกี่ยวกับ
photocatalytic
degradation ของสารที่มีสีที่ละลายอยู่ในน้ำ
แล้วใช้การวัดการดูดกลืนคลื่นแสงเพื่อวัดปริมาณ
"สารอินทรีย์"
ที่หลงเหลืออยู่
จึงต้องระวังในการเอาผลการทดลองนั้นมาใช้ให้มากด้วย
(ที่เขียนไว้ในเรื่อง
"สีหายไม่ได้หมายความว่าสารหาย")
รูปที่
๔ โมเลกุล Phenolphthalein
ที่ไม่มีสี
(ซ้าย)
เมื่อ
pH < 8.2 และมีสีม่วงแดง
(ขวา)
เมื่อ
pH > 10.0
การเปลี่ยนสีของ
Bromothymol
blue (รูปที่
๕)
ก็เป็นไปในทำนองเดียวกับกับกรณีของ
phenolphthalein
กล่าวคืออะตอม
C
ที่เชื่อมต่อวงแหวน
3
วงเข้าด้วยกัน
(ในวงกลมแดง)
เมื่ออยู่ในสภาพที่เป็นเบสที่มากพอจะเปลี่ยนโครงสร้างจากการเป็นพันธะอิ่มตัวกลายเป็นมีพันธะคู่เข้ากับวงแหวนวงหนึ่ง
ทำให้เกิดเป็นระบบ conjugated
double bond เชื่อมต่อวงแหวน
3
วงเข้าด้วยกันพร้อมกับการเกิดโครงสร้าง
p-quinoid
(กับวงแหวนที่อะตอม
C
นั้นสร้างพันธะคู่ด้วย)
รูปที่
๕ Bromothymol
blue เหลือง
(acidic
form) เมื่อ
pH < 6.0 และน้ำเงิน
(basic
form) เมื่อ
pH > 7.6 (จาก
http://en.wikipedia.org/wiki/File:Bromothymol_blue_protolysis.svg)
เขียนมาถึงตรงนี้ก็ไม่รู้เหมือนกันว่าพอจะช่วยให้พวกที่ทำงานด้านเกี่ยวกับพอลิเมอร์นำไฟฟ้าตอบคำถามได้ไหมว่าทำไมพอลิเมอร์นำไฟฟ้าที่เขาสังเคราะห์ขึ้นนั้นจึงมีสี
และคนที่ต้องเข้าไปเกี่ยวข้องกับงานพวก
photocatalytic
degradation ของสารที่มีสีที่ละลายอยู่ในน้ำ
ที่มักจะนิยมใช้การวัดการดูดกลืนคลืนแสงเป็นตัวบ่งบอกปริมาณสารที่ทำให้เกิดสีนั้น
ควรต้องระวังในการอ่านผลการทดลองอย่างไร
จะได้ไม่ถูกหลอก